Задача
Оценить влияние времени удерживания и глубины введения термометра на ректальные измерения температуры у шиншилл и определить степень соответствия между температурами, измеренными с помощью 2 тимпанических и ректального термометра.
Дизайн
Проспективное сравнение методов исследования.
Животные
47 здоровых шиншилл
Процедуры
Оценивалось влияние глубины введения ректального термометра на 1 и 2 см и влияние ручного удержания на срок до 5 минут. Почти одновременные измерения температуры были получены с помощью человеческого тимпанического термометра, ветеринарного тимпанического термометра и ректального термометра двумя наблюдателями. Двойные измерения температуры были получены для каждого из методов, а последовательность измерений была рандомизирована для каждого животного.
Результаты
Показания ректальной температуры, полученные на глубине 2 см, были значительно выше (среднее ± SD, 1,14 ± 0,77 ° C [2,05 ° 1,39 ° F]), чем полученные на глубине 1 см. Через 3 минуты ручное удерживание оказало значимое влияние на ректальную температуру. Референсный интервал ректальной температуры у шиншилл с глубиной введения термометра 2 см был рассчитан в диапазоне от 34,9 ° до 37,9 ° C (94,8 ° - 100,2 ° F). Оба тимпанических инфракрасных термометра имели значимую систематическую ошибку (0,42 ± 0,12 ° C [0,76 ° ± 0,22 ° F]) и пропорциональную ошибку (0,88 ± 0,14 ° C [1,58 ± 0,25 ° F]). Коэффициенты надежности для ректального термометра, человеческого и ветеринарного тимпанических термометров составляли 0,86, 0,85 и 0,69 соответственно.
Заключение и клиническая значимость
Глубина введения ректального термометра и длительность ручного удержания оказали значительное влияние на измерение ректальной температуры у шиншилл. Из-за значимой систематической и пропорциональной ошибок, тимпаническую термометрию нельзя считать подходящей заменой ректальной термометрии у шиншилл. (J Am Vet Med Assoc 2017;251:552–558)
Измерение температуры тела имеет важное значение для оценки состояния здоровья животных как в клинических, так и в исследовательских условиях. 1 Температура тела может быть измерена несколькими методами, которые обычно классифицируются в зависимости от инвазивности процедуры, расположения термометра, степени контакта между чувствительным элементом и пациентом, а также типа термометра. 2-5 Инвазивные методы мониторинга температуры включают катетеризацию артерий, катетеризацию мочевого пузыря и введение пищеводного зонда. 2,6,7 Эти методы требуют соответствующей седации или удержания пациента и технических навыков для получения измерений температуры. 4,5 Хотя данные инвазивные методы обеспечивают наиболее точные измерения температуры тела, они непрактичны для рутинного измерения температуры и обычно предназначены для мониторинга критических пациентов и при проведении исследования.2,7 Ректальная термометрия в настоящее время является наиболее клинически приемлемым и относительно неинвазивным методом измерения температуры тела у животных. Обычно используются стеклянные ртутные термометры, цифровые термометры или прогнозирующие термометры, которые находятся в контакте со слизистой оболочкой прямой кишки в течение различных периодов времени. 2,7 Стеклянные термометры используются реже и требуют больше времени, чтобы уравновесить температуру тела. Цифровые термометры требуют меньше времени, чем стеклянные, но обычно для измерения ректальной температуры все же требуется от 45 до 60 секунд. Цифровые прогнозирующие термометры требуют минимального времени измерения, поскольку они используют начальную скорость изменения температуры для прогнозирования окончательного показания температуры. 2,3
В ветеринарной медицине ректальное измерение температуры - это типичный метод, используемый для оценки температуры тела. 3-6,8,9 Однако измерение ректальной температуры требует соответствующего ручного удерживания и, следовательно, может вызвать стресс у животных, особенно у тех, кто не привык к ручному удерживанию. 10,11 Этот эффект может быть усилен в экспериментальных условиях 8, где протокол исследования может потребовать частых измерений. 8 Кроме того, стресс, связанный с удерживанием и измерением температуры, может оказывать отрицательное физиологическое воздействие на животное, повышая температуру тела и потенциально приводя к ложным предположениям относительно общего состояния здоровья животного. 7-10 Исследование 12 госпитализированных собак показало, что величина тахикардии и других поведенческих показателей стресса были выше, когда температура измерялась с помощью ректальной термометрии, в сравнении с другими методами. Кроме того, желудочно-кишечные переменные (например, перистальтика и объем фекального материала) могут влиять на измерения температуры, полученные с помощью ректального термометра. 3-5 Из-за этих факторов растет интерес к бесконтактным, неинвазивным методам измерения для оценки температуры тела у животных.
Было исследовано использование инфракрасных тимпанических термометров. 4,5 Этот метод обеспечивает относительно быстрое получение измерения температуры на относительно легкодоступном анатомическом участке. 2,6,9 Инфракрасные термометры измеряют количество излучения, испускаемого барабанной перепонкой, с помощью сенсорного зонда. 13 Датчик обнаруживает источник тепла, и инфракрасное излучение преобразуется в электрический сигнал и калибруется для отображения показаний температуры. 6,14 Поскольку барабанная перепонка разделяет кровоснабжение с гипоталамусом через сонную артерию, температура тела может быть аппроксимирована из этого измерения. 2,9,15 Однако, поскольку температура барабанной перепонки значительно ниже, чем центральная температура тела (гипоталамуса), тимпанический термометр имеет встроенное смещение, которое преобразует измеренную температуру в центральную температуру тела или ректальную температуру, чтобы компенсировать эту разницу. 15,16
Тимпаническая термометрия в настоящее время широко используется у пациентов из-за простоты и скорости использования. 13,14,16,17 Тимпаническая термометрия в ветеринарии оценивалась у нескольких видов, включая кошек,5,8 собак,2–4,12,18 кроликов,6 морских свинок,7 обезьян,9 коз,19 овец,19 коров,20 и лошадей.19 Тем не менее, результаты значимо различались между видами и между исследованиями, причем некоторые исследования 2,5,9,18,19 обнаружили большую согласованность между измерениями тимпанической и ректальной температуры, тогда как другие исследования 3,4,6,7,19 сообщают об отсутствии согласованности. Помимо видовых различий, различные исследования также сравнивали измерения тимпанического термометра с различными «золотыми стандартами». Хотя некоторые исследователи использовали инвазивные методы в качестве «золотого стандарта», 2,3,8 другие использовали коммерческие ректальные термометры с различной глубиной ректального введения.4-7,9,18 Следовательно, различия процедур и методов сравнения также могли повлиять на выводы предыдущих исследований.
Тимпанические термометры, предназначенные для использования человеком, были изучены и использованы в ветеринарной медицине. 4-6,9 Последние устройства имеют меньший размер зонда, что позволяет более точно разместить его в ушном канале. 9,18 Ушной канал у собак и кошек состоит из горизонтальных и вертикальных каналов, которые необходимо пройти, чтобы достичь барабанной перепонки. 9 Он отличается от относительно прямого слухового прохода у пациентов-людей, который обычно позволяет легче позиционировать датчик тимпанического термометра при регистрации температуры барабанной перепонки. 21 Слуховой канал у шиншилл расположен в дорсальном и вентральном направлениях, параллельно барабанной перепонке. 22,23 Мы не знаем о предыдущих исследованиях, оценивающих использование тимпанических термометров у шиншилл. Помимо того, что они являются домашними животными, шиншиллы широко используются в экспериментальных исследованиях отита медиа и потери слуха, а также в качестве экспериментального модельного животного при исследовании ототоксикоза. 23-29 Поскольку измерение ректальной температуры может занимать много времени и вызывать стресс, тимпаническая термометрия может предложить подходящую альтернативу для измерения температуры тела у шиншилл. Таким образом, цели исследования, о которых здесь сообщается, заключались в оценке клинической практичности и достоверности тимпанической термометрии у шиншилл, оценке влияния времени удерживания и глубины введения термометра при ректальных измерениях температуры, а также в определении степени соответствия между температурой, измеренной с помощью 2 тимпанических и ректального термометра. Мы предположили, что между результатами тимпанической и ректальной термометрии у шиншилл будет хорошая согласованность.
Материалы и методы
Животные
Сорок семь шиншилл (Chinchilla lanigera; 17 самцов и 30 самок) в возрасте от 4 месяцев до 8 лет и весом от 360 до 1240 г (от 0,8 до 1,7 фунта; среднее значение ± SD, 0,68 ± 0,16 кг [0,31 ± 0,07 фунта]) оценивались в 3 отдельных экспериментах. Одна группа (n = 17; 8 самцов и 9 самок) была получена из коммерческого племенного хозяйства а и размещена в Университете Висконсин-Мэдисон для нескольких исследований. Другая группа (n = 30; 9 самцов и 21 самка) содержалась в местном питомнике. Шиншиллы в обеих группах содержались в отдельных клетках в комнатах с климат-контролем с световым циклом 12 часов. В комнатах поддерживалась температура от 21,1 до 23,3 ° C (от 70 до 74 ° F) и относительная влажность от 35 до 60%. Шиншиллы питались коммерческим гранулированным рационом. Было определено, что все животные, включенные в исследование, изначально здоровы на основании результатов физикального осмотра, проведенного ветеринаром, и не имели никаких отклонений, отмеченных при отоскопическом осмотре, включая исследование барабанных перепонок. Животные с ушными аномалиями были исключены из исследования. Протокол исследования был одобрен Институциональным комитетом по уходу и использованию животных Школы ветеринарной медицины Университета Висконсин-Мэдисон.
Термометры
Измерения ректальной температуры были получены с помощью прогнозирующего цифрового термометра. b Ректальный термометр имел диапазон температур от 32,2 до 43,2 °C (от 90 до 108 °F), точность ± 0,1 °C (± 0,2 °F) и отображал значения температуры в пределах 10–20 секунд. Ректальный термометр был поверен по эталонному цифровому термометру, который используется Национальным институтом стандартов и технологий c на водяной бане при диапазоне температур от 32 ° до 41,3 °C (от 89,6 ° до 106,3 °F) 3 раза в течение всего периода исследования. Было обнаружено, что ректальный термометр измеряет среднее значение на 0,09 °C (0,16 °F) ниже, чем эталонный термометр (–0,09 °C [–0,16 °F]; пределы согласия 95%, от –0,34 ° до 0,12 °C [- От 0,61 до 0,22 °F]). В этом исследовании мы использовали ректальный термометр в качестве «золотого стандарта» из-за небольшой разницы между температурами, измеряемыми ректальным и контрольным термометрами.
Измерения тимпанической температуры были получены как с помощью человеческого, так и ветеринарного электронного инфракрасного термометра. Человеческий термометр отображал температуры в диапазоне от 34 ° до 42,2 °C (от 93,2 ° до 108 °F), с заявленной производителем точностью ± 0,2 °C (0,4 °F) для диапазона от 36 ° до 39 °C (от 96,8 ° до 102,2 °F) и с точностью ± 0,3 °C (0,5 °F) вне этого диапазона. Время измерения составляло <1 секунды. Ветеринарный тимпанический термометр имел те же значения, заявленные производителем касаемо диапазона и точности измерения температуры, и время измерения <1 секунды.
Влияние глубины введения термометра на ректальную температуру
Чтобы оценить влияние глубины ректального введения на измерения температуры, полученные с помощью ректального термометра, были проведены единичные ректальные измерения температуры при глубине введения 1 или 2 см у 13 шиншилл. Каждая шиншилла была расположена в вентральном положении, все 4 лапы лежали на руке ассистента, а ее голова была обращена к ассистенту. Один наблюдатель отвечал за получение всех ректальных измерений температуры. Ректальный термометр был смазан стерильной смазкой, повторные измерения ректальной температуры были получены для каждой шиншиллы при глубине введения 1 и 2 см случайным образом. Рандомизация проводилась с помощью компьютерной программы. е Оба измерения были выполнены менее чем через 1 минуту для каждого животного в течение одного периода удерживания.
Влияние ручного удерживания на ректальную температуру
Чтобы оценить влияние кратковременного ручного удерживания на ректальные измерения температуры, 17 шиншилл вручную удерживались в течение одного 5-минутного периода между 10:00 и 12:30. Каждая шиншилла была расположена в вентральном положении, все 4 ноги лежали на руке ассистента, а ее голова была обращена к ассистенту. В промежутках между снятием показаний температуры животное более крепко удерживалось рядом с грудью ассистента. Ректальная температура измерялась при глубине введения 2 см. После первоначального измерения температуры ректальную температуру измеряли идентичным образом с интервалами в 1 минуту в течение всего 5-минутного периода удерживания.
Тимпаническая и ректальная термометрия
Измерения температуры, полученные с помощью 2 тимпанических термометров d, e, сравнивались с данными, полученными с помощью ректального термометра, в общей сложности у 47 шиншилл. Все измерения были проведены между 9:30 и 12:30. Данные о температуре, полученные всеми тремя методами, были собраны в течение 88–200 секунд (среднее значение ± стандартное отклонение, 127 ± 25 секунд) после начала ручного удерживания. Измерения температуры были получены в двух экземплярах для каждого метода, а последовательность измерений была рандомизирована f для каждого животного. Два наблюдателя (1 слева и 1 справа) отвечали за все измерения, а животные были случайным образом f назначены каждому наблюдателю, причем один наблюдатель оценивал 24 животных, а другой - 23.
Ректальную температуру оценивали, как было описано, при глубине введения 2 см. Тимпаническую температуру измеряли в левом ухе, чтобы исключить возможное влияние вмешивающихся факторов между ушами животного. Одноразовые крышки надевались на каждый термометр перед использованием. Ушную раковину аккуратно поднимали для визуализации слухового прохода. Затем датчик помещали в ушной канал и располагали в направлении ростральной стороны основания противоположного уха. Это привело к наиболее последовательному расположению зонда в слуховом канале и вблизи барабанной перепонки. Термометр полностью извлекался из уха для записи показаний температуры до получения повторного измерения.
Статистический анализ
Влияние субъективных факторов (ректальный или тимпанический термометр) моделировалось с помощью линейной смешанной модели, при которой животное (шиншилла) использовалось как случайный фактор влияния, а метод (тип термометра) и порядок как фиксированные эффекты. Среднее систематическое влияние факторов было эквивалентно пересечению модели. Температуры, измеренные ректальным термометром (т. е. «золотой стандарт»), были включены в качестве фиксированной переменной, чтобы оценить наличие пропорционального систематического влияния различных факторов. Остаточные погрешности были проверены на нормальность и гомоскедастичность на основе квантильных и остаточных графиков. Для оценки вариабельности метода была также применена линейная смешанная модель с типами тимпанических термометров, повторениями и шиншиллами в качестве случайных переменных. Для этой последней модели была также реализована модель гетерогенной дисперсии для оценки разницы дисперсий между двумя термометрами, которая сравнивалась с моделью однородной дисперсии с помощью теста отношения правдоподобия. Коэффициент надежности был рассчитан для каждого метода как SD шиншиллы / SD общее как показатель согласованности измерений.30 Пределы согласованности были рассчитаны на основе дисперсии, полученной из смешанной модели, как ± 1,96 • SD общее. Влияние длительности удерживания на ректальную температуру оценивали с помощью линейной смешанной модели, в которой время было фиксированным фактором влияния, а животное (шиншилла) - случайным. Предположения были проверены, как было описано выше. Автокорреляция первого порядка во времени также проверялась с помощью оценки функции автокорреляции. Пост-хок сравнения различных моментов времени были сделаны с поправками Тьюки.
Ректальные температуры, полученные при глубине введения 1–2 см, сравнивались с использованием двусторонних парных t-критериев Стьюдента, с проверкой правильности и гомоскедастичности данных. Для всех анализов значения P <0,05 считались значимыми. Все анализы были выполнены с помощью статистического программного обеспечения. g, h
Результаты
Влияние глубины введения на ректальную температуру
При введении ректального термометра на глубину 1 см средняя ректальная температура ± SD составляла 35,3 ± 0,94 °C (95,5° ± 1,69°F), тогда как при глубине введения 2 см средняя ректальная температура ± SD составляла 36,4 ± 0,77 °C (97,5 ° ± 1,39 °F). Средняя разница между двумя показаниями составляла 1,14 ± 0,77 °C (2,05 ° ± 1,39 °F), при этом введение термометра на глубину 2 см приводило к значимо (P <0,001) более высоким температурам, чем при введении на глубину 1 см. Референсный 95%-интервал (среднее ± 2SD, распределение по Гауссу) для ректальных измерений у шиншилл, полученных при глубине введения 2 см, был рассчитан как 34,9 ° –37,9 °C (94,8–100,2 °F).
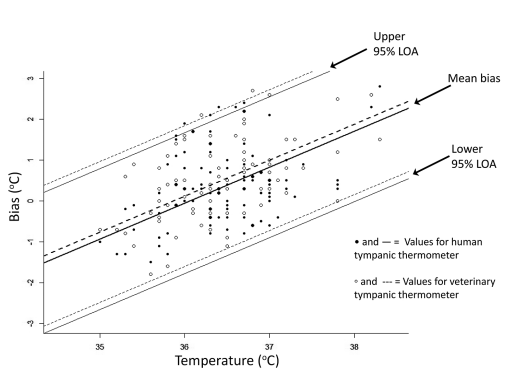
Рисунок 1 - Дифференциальная диаграмма, иллюстрирующая степень смещения между температурой, измеренной ректальной термометрией, и 2 тимпанскими термометрами у 47 шиншилл. Графики были построены с влиянием, вызванным субъективными факторами в качестве оси Y и ректальной температурой (т.е. эталонным стандартом) в качестве оси X. LOA = пределы согласия.
Прим. пер. к рис. 1: Bias (° C) – систематическая ошибка, вызванная влиянием субъективных факторов, Temperature (° C) – температура, Upper 95% LOA – выше 95% пределов согласия, Mean bias – разность средних значений, Lower 95% LOA – ниже 95% пределов согласия, закрашенный круг и сплошная линия – значения человеческого тимпанического термометра, незакрашенный круг и прерывистая линия – значения ветеринарного тимпанического термометра.
Влияние ручного удерживания на ректальную температуру
Ручное удерживание шиншилл оказывало значительное (P <0,001) влияние на ректальную температуру с течением времени. Ректальная температура значимо увеличилась (P = 0,029), спустя 3 минуты удержания, в среднем ± SEM 0,22 ± 0,07 °C (0,40 ° ± 0,13 °F). Через 5 минут ограничения среднее увеличение температуры ± SEM по сравнению с базовой температурой составило 0,35 ± 0,07 °C (0,63 ° ± 0,13 °F; P <0,001).
Тимпаническая термометрия против ректальной
Температуры, полученные с помощью как человеческого, так и ветеринарного инфракрасного термометров, имели значимую систематическую ошибку (0,42 ° ± 0,12 °C [0,76 ° ± 0,22 °F]; P <0,001). Систематическая ошибка ветеринарного тимпанического термометра был выше, чем у тимпанического термометра для человека, в среднем ± SEM 0,17 ° ± 0,08 °C (0,31 ° ± 0,14 °F; P = 0,038). Предел погрешности в районе смещения составил 1,73 ° C (3,11 ° F; 95% -ые пределы согласия = отклонение ± допустимая погрешность; рисунок 1). Имелась также значимая пропорциональная ошибка (0,88 ° ± 0,14 ° C [1,58 ° ± 0,25 ° F]; P <0,001), так что для каждого приращения температуры тела на 1 ° C (1,8 ° F) смещение увеличивалось на 0,88 °C. Величина пропорциональной ошибки была одинаковой между термометрами (то есть эффект взаимодействия температуры термометра X не был значительным). Значимой разницы дисперсий у 2 тимпанических термометров отмечено не было (P = 0,3). Коэффициенты надежности для ректального термометра, человеческого тимпанического термометра и ветеринарного тимпанического термометра составляли 0,86, 0,85 и 0,69 соответственно.
Обсуждение
В настоящем исследовании мы зафиксировали значительную и клинически значимую разницу в измерениях температуры у шиншилл при установке ректального термометра на 2 разных глубинах. При увеличении глубины введения термометра с 1 до 2 см ректальный термометр давал значительно более высокие показания. Другие исследования 20,31 также сообщают, что глубина введения ректального термометра влияет на измерения. 20,31 В предыдущих исследованиях 3–9 различных видов, где тимпанические термометры сравнивались с ректальными термометрами, при получении ректальной температуры использовалась различная глубина от 1 до 3 см. Однако некоторые авторы 18 не сообщали о глубине введения ректального термометра.
Ручное удерживание шиншилл привело к значимому повышению ректальной температуры в течение первых 3 минут удерживания. В то время как повышение ректальной температуры может иметь или не иметь клинического значения, следует избегать длительного удерживания на руках и сдерживания шиншиллы, если должна регистрироваться ректальная температура. Кроме того, мы предполагаем, что повышение ректальной температуры может повлиять на точность сравнений между устройствами, когда время, необходимое для сбора измерений, приближается к 3–5-минутной отметке. Ранее сообщалось, 10,11,32 что острый стресс, вызванный ручным сдерживанием, приводит к повышению температуры тела у многих видов. Исследование 32 чернобурых лис показало, что вызванная стрессом гипертермия стала очевидной в течение 5 минут после поимки, и температура продолжала повышаться в течение 1-часового периода удерживания. Таким образом, рекомендуется измерять температуру относительно рано, во время физикального осмотра, прежде чем животное будет удерживаться в течение более длительного периода времени. Это необходимо, чтобы получить измерение температуры, которое наиболее отражает состояние здоровья животного. 33 Шиншиллы особенно чувствительны к сильному сдерживанию руками и часто борются с возрастающим давлением. Стресс можно свести к минимуму, предоставляя адекватную поддержку животному без увеличения сдерживания и сохраняя минимальное время удерживания. 33
Влияние ручного сдерживания на ректальную температуру подчеркивает важность эффективного сбора данных при сравнении термометрических устройств. Если сбор данных продолжителен, могут быть сделаны ложные предположения об относительной точности и надежности устройств, особенно если порядок измерений температуры не рандомизирован. Предыдущие исследования часто не выдвигали на первый план важность времени удерживания и то, произошло ли повышение температуры в результате удерживания. В одном исследовании 6 кроликов отмечалось, что результаты измерения температуры не увеличивались в процессе удерживания, и продолжительность измерений температуры составляла от 5,5 до 9,5 минут. Предыдущие исследования по оценке тимпанических термометров у других видов также сильно различались по продолжительности сбора данных, а также от того, были ли методы сбора данных рандомизированы. В настоящем исследовании, сравнивая тимпаническую и ректальную термометрию, мы попытались минимизировать влияние вызванной стрессом гипертермии на наши результаты, ограничив время удержания до <200 секунд.
В настоящем исследовании измерения температуры барабанной перепонки, полученные с помощью как человеческих, так и ветеринарных тимпанических термометров, не соответствовали результатам ректальной термометрии у шиншилл. Однако ректальная термометрия не была подтверждена у шиншилл путем сравнения ее с результатами измерения температуры тела. Ректальная термометрия в настоящее время является клинически принятым стандартным методом измерения температуры тела у шиншилл; поэтому она была использована в данном исследовании в качестве «золотого стандарта». Для взаимозаменяемости используемых устройств новое устройство должно иметь приемлемый уровень точности и аналитическую согласованность с предыдущим методом. В то время как неинвазивный метод измерения температуры у этого вида был бы желательным для снижения стресса как в клинических, так и в исследовательских условиях, общая разница полученных значений у тимпанической и ректальной термометрии была слишком большой, что исключает его клиническое использование. Мы задокументировали значимую систематическую ошибку, а также пропорциональную ошибку при использовании ветеринарного тимпанического термометра, имеющего более высокую погрешность, чем человеческий. Погрешность была относительно широкой (1,7 ° C [3,1 ° F]), это указывает на то, что тимпанические термометры могут недооценивать или переоценивать ректальную температуру до 1,7 ° C у некоторых животных. Кроме того, на обоих концах исследованных температурных диапазонов наблюдалась тенденция к большим клиническим расхождениям.
В настоящем исследовании коэффициент надежности был также ниже у ветеринарного тимпанического термометра (0,69), чем у тимпанического человеческого (0,85) и ректального термометра (0,86). Это говорит о том, что повторные измерения, полученные с помощью ветеринарного тимпанического термометра, могут быть несогласованными. Таким образом, мы не можем рекомендовать ветеринарную тимпанальную термометрию для мониторинга температуры тела у шиншилл, тогда как надежность человеческого тимпанального термометра была сопоставима с надежностью ректального термометра. Таким образом, мы не можем рекомендовать ветеринарную тимпаническую термометрию для мониторинга температуры тела у шиншилл, тогда как надежность человеческого тимпанического термометра была сопоставима с надежностью ректального термометра.
Положительное смещение, отмеченное в настоящем исследовании, показало, что оба тимпанических термометра имели тенденцию регистрировать температуры, которые были ниже, чем значения, полученные с помощью ректальной термометрии. Предыдущие исследования сообщают о похожих результатах. У анестезированных кошек и обезьян температуры, полученные с помощью тимпанической термометрии, были ниже, чем температуры гипоталамуса, но хорошо коррелировали. 15 Исследование 6 кроликов также пришло к выводу, что тимпаническая термометрия зафиксировала более низкие температуры, чем ректальная. Более низкая тимпаническая температура может объясняться относительной близостью датчика температуры к окружающей среде по сравнению с другими методами и отсутствием изолирующих тканей, окружающих ушной канал. Положение и анатомические различия ушного канала шиншилл также могут способствовать снижению показаний температуры, полученных с помощью тимпанических термометров.
Различия в анатомии ушного канала, а также в расположении датчика, возможно, также способствовали общему несоответствию между методами термометрии у шиншилл в настоящем исследовании. Исследование 9 беличьих обезьян обнаружило хорошую согласованность между человеческими тимпаническими и ректальными термометрами. Возможно, это связано с тем, что прямой ушной канал беличьей обезьяны более похож на ушной канал человеческого младенца. 9 Однако исследование кроликов 6 показало отсутствие согласованности между данными о температуре, полученными с помощью человеческого, ветеринарного и ректального термометров; это может быть связано с наличием слепого дивертикула черепа в направлении слухового канала, а также с длинной вертикальной частью канала у кроликов, которая отличается от анатомии людей, а также других видов. 6 Исследование 7 морских свинок также обнаружило плохую согласованность при сравнении результатов измерений, полученных с помощью ветеринарного тимпанического термометра и ректального термометра. В связи с этим мы хотели бы подчеркнуть, что нельзя предполагать, что ветеринарные или тимпанические термометры для людей подходят для использования у всех видов.
Хотя ректальные температуры, зарегистрированные на глубине 2 см, были использованы в качестве эталонного («золотого») стандарта в настоящем исследовании, важно отметить, что не хватает существенных данных относительно нормальных температур тела у шиншилл. Большинство ресурсов перечисляют диапазоны температур, но не раскрывают глубину введения термометра, используемого для проверки этих параметров. Приведенные в литературе контрольные диапазоны температуры тела включают 36,1-37,8 ° С (97-100 ° F), 34 35,5-37,2 ° С (96-99 ° F), 33 и 37-38 ° С (98,6 ° - 100,4 ° F). 35 Референсный интервал, установленный на основе наших данных при глубине введения 2 см, составлял 34,9–37,9 ° C, что было аналогично ранее сообщенным референсным интервалам для шиншилл. Однако следует отметить, что в 2 исследованиях 33,34 указанный эталонный диапазон указал температуру > 36 ° C в качестве нижнего предела, тогда как эталонный диапазон, рассчитанный на основе наших измерений, имел нижний предел 34,9 °C.
Все животные, включенные в настоящее исследование, были признаны здоровыми и активными. Таким образом, результаты настоящего исследования следует интерпретировать с осторожностью, потому что эффективности оцениваемых термометров могут отличаться у шиншилл с аномальной температурой тела. Рекомендованы дальнейшие исследования, которые изучат и проверят применение ректальной и тимпанической термометрии у шиншилл как в здоровом, так и в болезненном состоянии.
Сноски
a. R & R Chinchilla Inc, Jenera, Ohio.
b. Vet-Temp Rapid Digital Thermometer DT-10, Advanced Monitors Corp, San Diego, Calif.
c. Traceable Digital Thermometer 15-077-8, Fisher Scientific, Pittsburgh, Pa.
d. Thermoscan IRT 4520, Braun, Southborough, Mass.
e. Vet-Temp VT-150, Advanced Monitors Corp, San Diego, Calif.
f. Research Randomizer, version 4.0, Geoffrey C. Urbaniak and Scott Plous, Middletown, Conn. Available at: www.randomizer.org. Accessed Nov 5, 2015.
g. R: a language and environment for statistical computing, R Foundation for Statistical Computing, Vienna, Austria. Available at: www.r-project.org. Accessed Nov 5, 2015.
h. nlme: Linear and Nonlinear Mixed Effects Models, R package, version 3.1-103, José Pinheiro, Douglas Bates, Saikat DebRoy, Deepayan Sarkar, and the R core team, Vienna, Austria. Available at: cran.r-project.org/web/packages/nlme/index.html. Accessed Nov 5, 2015.
Использованные источники
1. Lichtenberger M, Lennox AM. Critical care of the exotic companion mammal (with a focus on herbivorous species): the first twenty-four hours. J Exot Pet Med 2012;21:284–292.
2. Southward ES, Mann FA, Dodam J, et al. A comparison of auricular, rectal and pulmonary artery thermometry in dogs with anesthesia-induced hypothermia. J Vet Emerg Crit Care (San Antonio) 2006;16:172–175.
3. Greer RJ, Cohn LA, Dodam JR, et al. Comparison of three methods of temperature measurement in hypothermic, euthermic, and hyperthermic dogs. J Am Vet Med Assoc 2007;230:1841–1848.
4. Sousa MG, Carareto R, Pereira-Junior VA, et al. Comparison between auricular and standard rectal thermometers for the measurement of body temperature in dogs. Can Vet J 2011;52:403–406.
5. Sousa MG, Carareto R, Pereira-Junior VA, et al. Agreement between auricular and rectal measurements of body temperature in healthy cats. J Feline Med Surg 2013;15:275–279.
6. Chen PH, White CE. Comparison of rectal, microchip transponder, and infrared thermometry techniques for obtaining body temperature in the laboratory rabbit (Oryctolagus cuniculus). J Am Assoc Lab Anim Sci 2006;45:57–63.
7. Stephens Devalle JM. Comparison of tympanic, transponder, and noncontact infrared laser thermometry with rectal thermometry in strain 13 guinea pigs (Cavia porcellus). Contemp Top Lab Anim Sci 2005;44:35–38.
8. Quimby JM, Olea-Popelka F, Lappin MR. Comparison of digital rectal and microchip transponder thermometry in cats. J Am Assoc Lab Anim Sci 2009;48:402–404.
9. Long CT, Pacharinsak C, Jampachaisri K, et al. Comparison of rectal and tympanic core body temperature measurement in adult Guyanese squirrel monkeys (Saimiri sciureus sciureus). J Med Primatol 2011;40:135–141.
10. Vinkers CH, Klanker M, Groenink L, et al. Dissociating anxiolytic and sedative effects of GABAAergic drugs using temperature and locomotor responses to acute stress. Psychopharmacology (Berl) 2009;204:299–311.
11. Mans C, Guzman DS, Lahner LL, et al. Sedation and physiologic response to manual restraint after intranasal administration of midazolam in Hispaniolan Amazon parrots (Amazona ventralis). J Avian Med Surg 2012;26:130–139.
12. Gomart SB, Allerton FJ, Gommeren K. Accuracy of different temperature reading techniques and associated stress response in hospitalized dogs. J Vet Emerg Crit Care (San Antonio) 2014;24:279–285.
13. Betta V, Cascetta F, Sepe D. An assessment of infrared tympanic thermometers for body temperature measurement. Physiol Meas 1997;18:215–225.
14. Fortuna EL, Carney MM, Macy M, et al. Accuracy of non-contact infrared thermometry versus rectal thermometry in young children evaluated in the emergency department for fever. J Emerg Nurs 2010;36:101–104.
15. Baker MA, Stocking RA, Meehan JP. Thermal relationship between tympanic membrane and hypothalamus in conscious cat and monkey. J Appl Physiol 1972;32:739–742.
16. Weiss ME, Sitzer V, Clarke M, et al. A comparison of temperature measurements using three ear thermometers. Appl Nurs Res 1998;11:158–166.
17. Zhen C, Xia Z, Ya Jun Z, et al. Accuracy of infrared tympanic thermometry used in the diagnosis of fever in children: a systematic review and meta-analysis. Clin Pediatr (Phila) 2015;54:114–126.
18. González AM, Mann FA, Preziosi DE, et al. Measurement of body temperature by use of auricular thermometers versus rectal thermometers in dogs with otitis externa. J Am Vet Med Assoc 2002;221:378–380.
19. Goodwin S. Comparison of body temperatures of goats, horses, and sheep measured with a tympanic infrared thermometer, an implantable microchip transponder, and a rectal thermometer. Contemp Top Lab Anim Sci 1998;37:51–55.
20. Burfeind O, von Keyserlingk MAG, Weary DM, et al. Short communication: repeatability of measures of rectal temperature in dairy cows. J Dairy Sci 2010;93:624–627.
21. Tarabichi M, Marchioni D, Presutti L, et al. Endoscopic transcanal ear anatomy and dissection. Otolaryngol Clin North Am 2013;46:131–154.
22. Suckow M, Stevens K, Wilson R. The laboratory rabbit, guinea pig, hamster and other rodents. St Louis: Academic Press, 2012.
23. Vrettakos PA, Dear SP, Saunders JC. Middle ear structure in the chinchilla: a quantitative study. Am J Otolaryngol 1988;9:58–67.
24. Reid SD, Hong W, Dew KE, et al. Streptococcus pneumoniae forms surface-attached communities in the middle ear of experimentally infected chinchillas. J Infect Dis 2009;199:786–794.
25. Bakaletz LO. Chinchilla as a robust, reproducible and polymicrobial model of otitis media and its prevention. Expert Rev Vaccines 2009;8:1063–1082.
26. Yokell Z, Wang X, Gan RZ. Dynamic properties of tympanic membrane in a chinchilla otitis media model measured with acoustic loading. J Biomech Eng 2015;137:081006.
27. Murrah KA, Turner RL, Pang B, et al. Replication of type 5 adenovirus promotes middle ear infection by Streptococcus pneumoniae in the chinchilla model of otitis media. Pathog Dis 2015;73:1–8.
28. Fisch RO, Eaton BG, Giebink GS. Tympanic membrane temperature during experimental otitis media due to Streptococcus pneumoniae in chinchillas. Lab Anim Sci 1982;32:278–279.
29. Apicella MA. Bacterial otitis media, the chinchilla middle ear, and biofilms. J Infect Dis 2009;199:774–775.
30. Vangeneugden T, Laenen A, Geys H, et al. Applying linear mixed models to estimate reliability in clinical trial data with repeated measurements. Control Clin Trials 2004;25:13–30.
31. Lee J-Y, Wakabayashi H, Wijayanto T, et al. Differences in rectal temperatures measured at depths of 4–19 cm from the anal sphincter during exercise and rest. Eur J Appl Physiol 2010;109:73–80.
32. Moe RO, Bakken M. Effects of handling and physical restraint on rectal temperature, cortisol, glucose and leucocyte counts in the silver fox (Vulpes vulpes). Acta Vet Scand 1997;38:29–39.
33. Riggs S, Mitchell M. Chinchillas. In: Mitchell M, Tully T, eds. Manual of exotic pet practice. St Louis: Saunders-Elsevier, 2009;474–492.
34. Mayer J. Rodents. In: Carpenter JW, ed. Exotic animal formulary. 4th ed. St Louis: Saunders-Elsevier, 2013;504.
35. Quesenberry KE, Donnelly TM, Mans C. Biology, husbandry and clinical techniques of guinea pigs and chinchillas. In: Quesenberry KE, Carpenter JW, eds. Ferrets, rabbits, and rodents: clinical medicine and surgery. St Louis: Saunders-Elsevier, 2012;279–294.
Авторы: Sarah Ozawa dvm, Christoph Mans dr med vet, Hugues Beaufrère dr med vet, phd
From the Department of Surgical Sciences, School of Veterinary Medicine, University of Wisconsin, Madison, WI 53706 (Ozawa, Mans); and the Health Sciences Centre, Ontario Veterinary College, University of Guelph, Guelph, ON N1G 2W1, Canada (Beaufrère). Dr. Ozawa’s present address is School of Veterinary Medicine, University of California-Davis, CA 95616.
Перевод на русский язык: Д.В. Михайлов
S. Ozawa, C. Mans, H. Beaufrère. Comparison of rectal and tympanic thermometry in chinchillas (Chinchilla lanigera) (Сравнение ректальной и тимпанической термометрии у шиншилл (Chinchilla lanigera)) // JAVMA, Vol 251, No. 5, 552-558
