Listeria monocytogenes является факультативно анаэробной короткой грамположительной палочковидной бактерией, которая поражает широкий спектр животных, включая жвачных животных, моногастричных животных, птиц, рыб, грызунов и людей. Заражение этим облигатным внутриклеточным патогеном вызывает 3 различных клинических проявления: сепсис, энцефалит и аборт, которые редко происходят одновременно у одного и того же животного. Сепсисная форма поражает внутренние органы с менингоэнцефалитом или без него и часто встречается у животных с однокамерным желудком, тогда как энцефалит и аборт происходят главным образом у взрослых жвачных животных. Шиншиллы считаются одним из видов, наиболее восприимчивых к висцеральному листериозу, 6,7,11 особенно если их разводить в замкнутом пространстве. 6 Листериоз у шиншилл был описан во многих районах Соединенных Штатов в период (1949-1955 гг.), когда шкуры шиншилл были ценным товаром в меховой промышленности.9,11,12 Совсем недавно, шиншиллы стали широко используемой моделью животных для исследований потери слуха, вызванной шумом. 4
Вспышка диссеминированного висцерального листериоза произошла в племенной колонии из 130 шиншилл, расположенной в северной части Айдахо. Шиншиллы там выращивались ради шкурок. Практиковалось полигамное размножение; 1 самец имел доступ к 8 самкам. Корм, открытые мешки с коммерческими гранулами для шиншилл и тюк с сеном, хранили на деревянном поддоне. Чтобы способствовать уходу за шерстью, животным была предоставлена чаша с пылью для купания. В декабре 1995 года в здание, где содержались шиншиллы, случился необычайно большой приток мышей, и несколько раз владельцы отмечали помет мыши в корме. К январю 1996 года у племенных животных разного возраста смертность составляла 23% (30 из 130). Приблизительно за 4 дня до смерти животные имели анорексию и горбились, а у некоторых наблюдалась кривошея. Многие животные были найдены мертвыми без предшествующих клинических признаков. Четыре шиншиллы (2 мертвых самца, 1 мертвая самка, 1 умирающая самка) были отправлены в Вашингтонскую диагностическую лабораторию болезней животных для проведения вскрытия.
Все 4 шиншиллы были истощены и испытывали недостаток подкожного и забрюшинного жира. Согласующиеся обширные поражения у 3 мертвых шиншилл включали мультифокальные белые очаги диаметром 0,1-0,3 см, поражающие капсулу и паренхиму печени, брыжеечные лимфатические узлы и серозную оболочку тонкого и толстого кишечника, особенно слепую кишку и толстый кишечник. Индивидуальные различия посмертных поражений перечислены в таблице 1. Животное А, мертвая самка, имело 2-см выпадение прямой кишки и инвагинацию толстой кишки в дополнение к висцеральным очагам. Инвагинация состояла из 3-сантиметрового сегмента темно-красного проксимального отдела толстой кишки, телескопированного в дистальный отдел толстого кишечника. У животного B, мертвого самца, наблюдались участки отложения фибрина, прикрепленные к висцеральной и париетальной плевре, перикарду и диафрагме, и абсцесс диаметром 1 см, расположенный на верхушке сердца. Умирающая самка, животное D, имела небольшой наклон головы и желтовато-коричневые слизистые выделения из влагалища. После эвтаназии и вскрытия было отмечено, что выделения из влагалища распространялись в матку (mucometra). Никакого иного вовлечения внутренних органов у этого животного отмечено не было.
На основании посмертных результатов были рассмотрены следующие дифференциальные этиологические агенты: L. monocytogenes, Salmonella sp. и Yersina pseudotuberculosis. Образцы головного мозга, легких, селезенки и жидкости из грудной полости ото всех животных, а также образец мазка из матки от животного D были собраны при вскрытии для бактериологических культур. Мозг, легкие, селезенка и грудная жидкость были инокулированы на агар с овечьей кровью и сывороточно-теллуритовый агар. a Кишечное содержимое культивировали на среде Макконки, обогащенной сальмонеллой с селенитовым бульоном с последующей субкультурой до бриллиантового зеленого агара и лизиновым железосодержащим агаром.a Образец мазка из матки культивировали на кровяном агаре и чашках МакКонки. a Полный набор тканей был собран и фиксирован в 10% нейтральном буферном формалине для гистопатологического исследования. Ткани были заключены в парафин, секционированы на 3 мкм и окрашены гематоксилином и эозином.
Гистологически у всех животных были случайные многоочаговые области гепатоцеллюлярного некроза и воспаления в степени от острого до подострого. Продукты клеточного распада, пикнотические ядра и нейтрофилы были расположены в центре, с небольшим количеством лимфоцитов и гистиоцитов на периферии очагов некроза (Рис. 1A). Трансмуральное воспаление стирало пейеровы быляшки тонкой кишки и мультифокальные области слепой кишки и толстого кишечника (Рис. 2A). Мезентериальные лимфатические узлы имели крупные некротические очаги, содержащие дегенеративные нейтрофилы, окруженные макрофагами, лимфоцитами и плазматическими клетками. Срезы селезенки имели многоочаговые зоны некроза и отложения фибрина. Животное B имело острый или подострый плеврит и перикардит, состоящий из фибрина, нейтрофилов, макрофагов и пролиферативных фибробластов. Перикард и эпикард были заменены чередующимися зонами пролиферативных фибробластов, фибрина и дегенеративных нейтрофилов. Матка животного D имела гиперпластические эндометриальные железы и слабый метрит с умеренным количеством макрофагов и лимфоцитов. Только животное D имело многоочаговый характер слияния микроабсцессов и изменение плотности каудальной части головного мозга и мозгового ствола. В повторных срезах Брауна и Хоппса этих тканей бактерий обнаружено не было.
Чтобы идентифицировать антигены листериоза в тканях с воспалительными поражениями, отдельные парафиновые срезы, фиксированные формалином, были иммуноокрашены коммерчески доступной кроличьей поликлональной антисывороткой против L. monocytogenes b (разведение 1: 2000). Модификацию опубликованной процедуры авидин-биотин-иммунопероксидазы 14 проводили с использованием набора для окрашивания,c биотинилированным козьим анти-кроличьим иммуноглобулином в качестве вторичного антитела,c и 3-амино-9-этилкарбазолом (AEC) d в качестве хромогена. Перед иммуным мечением срезы тканей депарафинизировали в Pro-par, с дегидратировали в 100% этаноле, блокировали для эндогенных пероксидаз с 3% перекисью водорода в метаноле, регидратировали в градуированном спирте и воде, блокировали для неспецифичного связывания первичного антитела с 3% козьей сывороткой и переваривали 0,1% проназой f в течение 10 минут при 37 ° С. Позитивная контрольная ткань состояла из фиксированной в формалине фетальной бычьей печени с некрозом печени, из которой L. rnouocytogenes был выделен до фиксации в чистой культуре. Отрицательной контрольной тканью при тестировании была нормальная (неиммунная) кроличья сыворотка, нанесенная на зараженный листерией срез печени крупного рогатого скота и ткани шиншиллы. С использованием этой методики были идентифицированы антиген-положительные остатки в виде внутриклеточного (у нейтрофилов и макрофагов) темно-красного окрашивания коротких палочек и скоплений организмов в пределах микроабсцессов и некротических очагов в стволе головного мозга животного D, при абсцессе перикарда у животного В и в печени и кишечнике животных A, B и C (Рис. 1B, 2B). Этим методом также были выделены редкие внеклеточные антигены листериоза.
Таблица 1. Лабораторные результаты 4 шиншилл (A-D)
|
|
Погибшая самка (A)
|
Погибший самец (B)
|
Погибший самец (C)
|
Живая самка (D)
|
|
Макроскопические поражения
|
Очаги некроза и абсцессы печени, кишечного тракта, кишечных лимфоузлов, инвагинация толстого отдела кишечника, ректальный пролапс
|
Очаги некроза и абсцессы печени, кишечного тракта, кишечных лимфоузлов, плеврит, перикардиальный абсцесс
|
Очаги некроза и абсцессы печени, кишечного тракта, кишечных лимфоузлов
|
Мукометра
|
|
Микроскопические поражения
|
Острый некротизированный гепатит, энтерит, спленит, лимфаденит
|
Острый некротизированный гепатит, слабый серозит кишечного тракта, острый
|
Острый некротизированный гепатит, энтерит, спленит, лимфаденит
|
Микроабсцессы и некроз мозга, легкий метрит
|
|
Иммуногистохимия (Listeria Ag+)
|
Печень, кишечник и лимфатические узлы
|
Печень, кишечник, лимфатические узлы и перикардиальный абсцесс
|
Печень, кишечник и лимфатические узлы
|
Микроабсцесссация мозга
|
|
Изоляция
Листерия+
Смешанная культура+
|
Мозг
Мозг
|
Легочная, торакальная жидкость
|
Селезенка
Мозг, торакальная жидкость
|
Мозг
|
В течение 3 дней после поступления в лабораторию многочисленные бактерии были выделены из культур легких и грудной жидкости (животное B), селезенки (животное C) и образцов мозга (животные A, D) и идентифицированы как L. monocytogenes на основе следующих критериев: грамм-положительное окрашивание, бета-гемолиз на агаре с овечьей кровью, положительная каталазная реакция, положительный CAMP-тест с Staphylococcus auerus, отрицательная ферментация D-ксилозы и подвижность при 20 ° C в уколочной культуре агара с маннитом. Подтверждение было выполнено с 1 изолятом с использованием системы идентификации API 20 STREP.g Listeria была выделена в 2 из 4 образцов головного мозга, включая животное D, с микроабсцессами ствола мозга и животное A, которое не имело макроскопических или микроскопических поражений (таблица 1). Изоляты Listeria у всех животных были чувствительны к различным антибиотикам, включая пенициллин, тетрациклин, триметаприн-сульфадиазин и хлорамфеникол. Смешанный рост бактерий был культивирован из мозга животных A и C и из грудной жидкости животного C, что указывает на возможное загрязнение или чрезмерный рост после смерти. Много S. aureus было восстановлено из образца мазка из матки шиншиллы D. Salmonella или Campylobacter не были выделены из образцов кишечника, культивированных, как было описано ранее. При окрашивании Викторией голубой Campylobacter не был обнаружен. Хотя образцы кишечника не культивировали специально для листерий, инфекция кишечного тракта была продемонстрирована иммуногистохимически у животных A, B и C (таблица 1).
Наиболее распространенным проявлением листериоза у шиншилл является возникновение микроабсцессов печени, брыжеечных лимфатических узлов и тонкого и толстого кишечника. 3,10 Кишечная инвагинация и выпадение прямой кишки были зарегистрированы как осложнения энтерита. 5 Эти поражения можно спутать с поражениями, вызванными Y. pseudotuberculosis и Salmonella у шиншилл. 6 Бактериологическая изоляция и иммуногистохимические методы подтвердили присутствие Listeria в данной племенной колонии шиншилл. Хотя Listeria чаще всего выделяется из печени, кишечника, толстого кишечника и селезенки у шиншилл, организм также выделяется из легких, сердца и мозга. 5,10,11 Кривошея является часто описываемым симптомом у шиншилл с вызванным листерией менингоэнцефалитом. 6,11 У шиншиллы D был энцефалит ствола головного мозга без признаков сепсиса или инфекции желудочно-кишечного тракта. Хотя возбудитель у шиншиллы D мог проникнуть в мозг через полость рта. Это предположительный путь проникновения Listeria в мозг жвачных, при котором проникновение через аксоны и тройничный нерв приводит к проникновению её в слизистую оболочку полости рта и зубную пульпу, когда животные ломают или теряют зубы 2, однако никаких поражений полости рта у этого животного не наблюдалось. Однако макроскопические раны полости рта не являются необходимыми для развития менингоэнцефалита; он может быть воспроизведен у мышей и кроликов с помощью микроскопической инокуляции L. monocytogenes в губе. 1 Поскольку микроскопическое исследование тройничного нерва и его ветвей в полости рта у этих шиншилл не проводилось, такой путь заражения не может быть подтвержден. Гематогенный путь заражения не считался вероятным из-за отсутствия септицемического процесса.
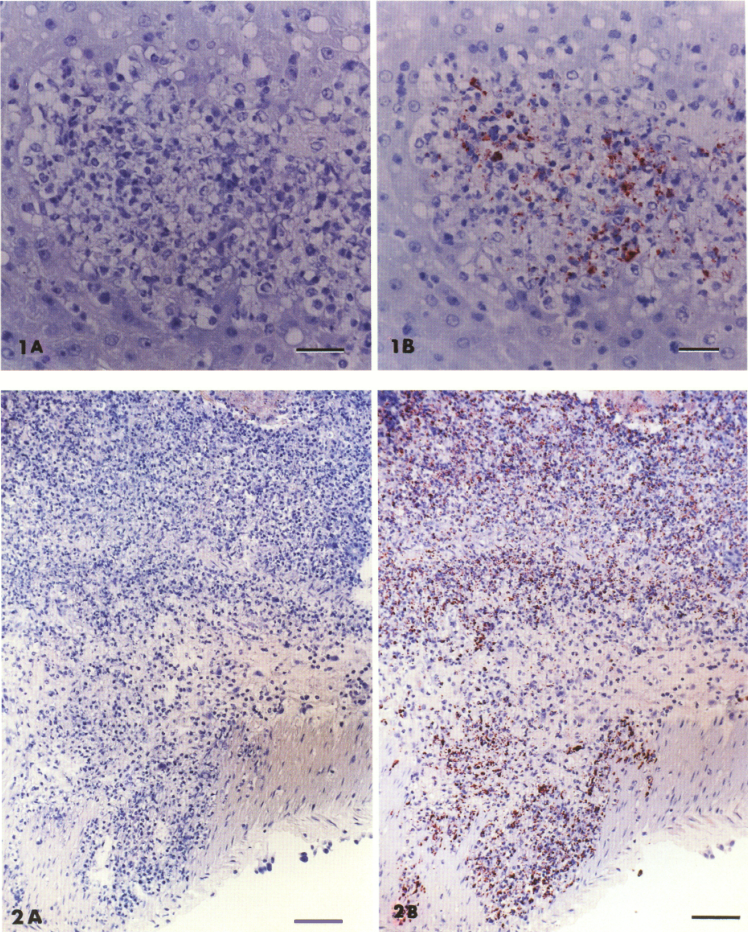
Рисунок 1. Иммунопероксидазное окрашивание очага некротического гепатоза печени шиншиллы с (A) сывороткой с отрицательным контрольным веществом и (B) антисывороткой против Listena monocytogenes, с выявлением нескольких антиген-положительных остатков и коротких палочек. AEC хромоген, окрашенный гематоксилином. Отрезок = 25 мкм.
Рисунок 2. Иммунопероксидазное окрашивание трансмурального микроабсцесса с некрозом слепой кишки у шиншиллы с (А) отрицательной контрольной сывороткой и (В) антисывороткой против Listeria monocytogenes, изображающее множество внутриклеточных и внеклеточных бактерий. AEC хромоген, окрашенный гематоксилином. Отрезок = 70 мкм.
Преобладание инфекции желудочно-кишечного тракта у шиншилл A, B и C наводит на мысль о оральном проникновении через загрязненный корм. Сено, загрязненное фекалиями грызунов, кур или жвачных животных, причастно к вспышкам листериоза у шиншиллы, и устранение такого загрязненного корма часто останавливает развитие новых инфекций. 3,5 Кроме того, висцеральный синдром был воспроизведен экспериментально у взрослых небеременных шиншилл и белых мышей путем оральной инокуляции L. monocytogenes. 7,9 Хотя гранулированный корм и сено не культивировались во время этой вспышки, они, предположительно, были загрязнены пометом мышей или экскрементами жвачных. Этот патоген также мог легко передаваться между животными при копрофагии, так как животные испражнялись в емкость для купания во время пылевых ванн, и эта ванна переносилась из клетки в клетку. Рекомендации по прерыванию цикла оральной передачи включали удаление загрязненного корма, эвтаназию и утилизацию всех умирающих животных, а также дезинфекцию клеток, поилок и пылевых ванн. Владельцы прекратили кормить шиншилл сеном, хранили гранулированный корм в закрытом металлическом контейнере, обеспечили отдельные пылевые ванны, усыпили 30 больных животных и устранили мышей из помещений. В последующие 6 месяцев проблем не возникало.
Listeria monocytogenes был выделен из тканей и легко идентифицирован в течение 72 часов бактериальной культурой без холодного обогащения. Листериальные антигены могут быть обнаружены в тканях шиншиллы иммуногистохимически с использованием коммерчески доступной кроличьей поликлональной антисыворотки, которая проверяет наличие внутриклеточных бактерий в микроабсцессах и некротических очагах, даже если окрашивание ткани по Граму этого не делает. Сообщалось о невозможности окрашивания по Граму для обнаружения листерий в срезах головного мозга крупного рогатого скота с совместимыми гистологическими повреждениями и клетками спинномозговой жидкости людей. 8,13 Быстрый иммуногистохимический тест, используемый для шиншилл в данной работе, можно использовать для проверки организмов Listeria, если ткани недоступны для культивирования. Отсутствие окрашивания по Граму, вероятно, связано с обязательным внутриклеточным жизненным циклом листерий. Этот конкретный организм способен использовать актиновый механизм клетки-хозяина для продвижения через цитоплазму одной клетки в другую клетку без воздействия внеклеточной среды. 13
Благодарность
Мы благодарим преподавателей и сотрудников Вашингтонской лаборатории по диагностике заболеваний животных за критический анализ рукописи и техническую экспертизу при проведении диагностических тестов.
Источники и производители
-
Becton Dickinson, Cockeysville, MD.
-
Listeria O antiserum poly, serotypes 1 and 4, Difco, Detroit, MI.
-
Vector Laboratories Burlingame, CA.
-
BioGenex, San Ramon, CA.
-
Anatech, Battlecreek, MN.
-
Protease Type XIV, Sigma Chemical Co., St. Louis, MO.
-
Biomerieux, Hazelwood, MO.
Использованная литература
-
Asahi O, Hosoda T, Akiyama Y: 1957, Studies on the mechanism of infection of the brain with Listeria monocytogenes. Am J Vet Res 19:147-157.
-
Barlow RM, McGorum B: 1985, Ovine listerial encephalitis: analysis, hypothesis and synthesis. Vet Rec 116:233-236.
-
Cavill JP: 1967, Listeriosis in chinchillas (Chinchilla laniger). Vet Rec 80:592-594.
-
Clark WW: 1991, Recent studies of temporary threshold shift (TTS) and permanent threshold shift (PTS) in animals. J Acoust Soc Am 90:155-163.
-
Finley GG, Long JR: 1977, An epizootic of listeriosis in chinchillas. Can Vet J 18: 164-167.
-
Gorham JR, Farrell K: 1955, Diseases and parasites of chinchillas. Proc Annu Meet Am Vet Med Assoc 92:228-234.
-
Gray ML, Killinger AH: 1966, Listeria monocytogenes and listeric infections. Bacteriol Rev 30:309-382.
-
Johnson GC, Fales WH, Maddox CW, Ramos-Vara JA: 1995, Evaluation of laboratory tests for confirming the diagnosis of encephalitic listeriosis in ruminants. J Vet Diagn Invest 7:223-228.
-
Leader RW, Holte RJA: 1955, Studies on three outbreaks of listeriosis in chinchilla. Cornell Vet 45:78-83.
-
McDonald DW, Wilton GS, Howell J, Klavano GG: 1972, Listeria monocytogenes isolations in Alberta, 1951-1970. Can Vet J 13:69-71.
-
Shalkop WT: 1950, Listeria monocytogenes isolated from chinchillas. J Am Vet Med Assoc 116:447-448.
-
Smith HC: 1953, Isolation of Listeria monocytogenes from chinchillas. Vet Med 48:294-295.
-
Southwick FS, Purich DL: 1996, Intracellular pathogenesis of listeriosis. N Engl J Med 334:770-775.
-
Weinstock D, Horton SB, Rowland PH: 1995, Rapid diagnosis of Listeria monocytogenes by IHC in fonnalin-fixed brain tissue. Vet Pathol 32: 193-195.
M. J. Wilkerson, A. Melendy, E. Stauber. An outbreak of listeriosis in a breeding colony of chinchillas // J Vet Diagn Invest 9:320-323 (1997)
From the Washington Animal Disease Diagnostic Laboratory (Wilkerson, Melendy) and The Department of Veterinary Clinical Sciences (Stauber), College of Veterinary Medicine, Washington State University, Pullman, WA 991652037. Current addresses: Department of Diagnostic Medicine/Pathobiology, College of Veterinary Medicine, Kansas State University Manhattan, KS 66506 (Wilkerson), and 127 Elongrove Ave.#9, Providence, RI 02906 (Melendy).
Принято к публикации 5 июля 1996 г.
Перевод: Д.В. Михайлов. Переводчик благодарит Е.К. Климочкину за редактирование.
M. J. Wilkerson, A. Melendy, E. Stauber. An outbreak of listeriosis in a breeding colony of chinchillas (Вспышка листериоза в племенной колонии шиншилл) // J Vet Diagn Invest 9:320-323 (1997)
