КЛЮЧЕВЫЕ МОМЕНТЫ
ВВЕДЕНИЕ
Репродуктивная физиология шиншиллы (Chinchilla laniger) является субъектом различных исследований из-за несоответствия данных, полученных в более ранних работах.1 Ее небольшой размер и сложность взятия повторных проб крови в течение длительных периодов заставляют различных авторов полагаться на альтернативные техники контроля эндокринной оси, дающие важные результаты, но часто контрастирующие друг с другом. Среди них, анализ фекального прогестерона был наиболее часто используемым и позволял лучше понять циклическую активность этого нового животного. Знание таких данных может помочь в интенсивном размножении этого вида и любом возможном проекте по сохранению шиншилл в дикой природе.
РЕПРОДУКТИВНАЯ ФИЗИОЛОГИЯ ШИНШИЛЛЫ
Половая зрелость
Самка шиншиллы проявляет половое созревание после достижения окончательного веса взрослой особи, происходящее примерно в 240 дней 2; самец шиншиллы приобретает способность к оплодотворению к восьмому месяцу. В целях размножения лучше использовать животных, которые достигли возраста как минимум 1.5 года.3 Тем не менее, литература по этому вопросу не согласна с тем, когда наступает половая зрелость у самки шиншиллы; принятый диапазон варьируется от 8 недель до 540 дней.4-9
Цикл эструса
Основная характеристика этих гистрикоморфных грызунов (шиншилла и морская свинка), которая значительно отличает их от миоморфных грызунов (крыса и мышь), это удивительно длинный цикл эструса. Взрослая самка шиншиллы развивает циклическую активность сезонного полиэструса (течка происходит несколько раз в течение определенного времени года) с положительным типом фотопериода 10,11, даже при размножении чаще всего наблюдается продолжающийся полиэструсный тип активности цикла. 12-15 Фактически, в условиях размножения рождение чаще всего происходит круглый год. Цикл эструса длится от 20 до 60 дней, 16 со средним репродуктивным периодом 35 дней.10 Овуляция происходит спонтанно, совпадая с течкой.2 Иногда самка шиншиллы демонстрирует «тихую течку», или точнее, не сопровождающуюся открытием вагинальной щели, в особенности в неблагоприятные месяцы спаривания.3 На широте автора (41° -54° с.ш., 12°-27° в.д.) период размножения обычно начинается в январе или феврале, хотя возможно наблюдать самок шиншилл в течке и в течение второй половины октября. Половая активность имеет тенденцию уменьшаться в течение летних месяцев, особенно в июле и августе, когда регистрируется наименьшее количество эпизодов. У диких шиншилл, которые живут в южном полушарии с сезонами, которые инвертированы относительно автора, можно наблюдать 2 периода спаривания: середина зимы (с июня по август) и середина лета (с декабря по февраль). Спаривание в эти периоды дает максимальное количество рождений в течение менее суровых сезонов (от весны к осени). Конкретно, в дикой природе наибольшее количество родов наблюдается весной (с октября по ноябрь); менее частые роды осенью.3
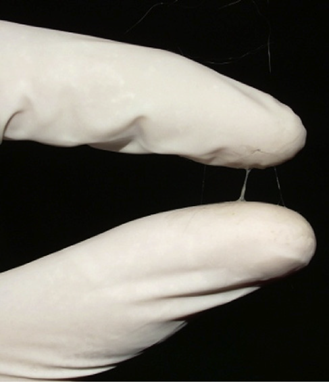
Эструс шиншиллы длится от 12 до 48 часов, и в течение этого времени самка шиншиллы может принять самца.2 Наиболее типичным проявлением эструса у самки шиншиллы является открытие вагинальной щели (рис. 1), а также выделение вязкого, прозрачного, слизистого секрета (рис. 2), не сопровождаемого каким-либо отеком наружных половых органов.17-20
Рис. 1. Самка шиншиллы во время эструса
Рис. 2. Вязкий, прозрачный, слизистый секрет, типичный для шиншиллы во время эструса
Спаривание
Поскольку эти животные чрезвычайно робки и особенно активны ночью, часто бывает трудно наблюдать акт спаривания. Тем не менее, есть наблюдения, которые можно сделать утром, чтобы удостовериться, что спаривание состоялось.
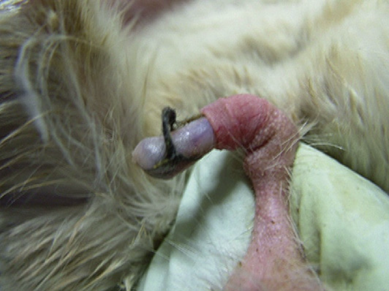
Конечно, наиболее характерным признаком является обнаружение «копуляционной пробки». 16,21-25 Сперма, после эякуляции во влагалище, коагулирует, формируя «пробку», которая препятствует выходу семенной жидкости. Через несколько часов после того, как произошло спаривание, сокращения влагалища выталкивают эту пробку, и пробку можно найти в клетке. Форма этой пробки напоминает хризалид и имеет размеры 2,5 см в длину и 6,7 мм в диаметре, имеет желтый цвет и консистенцию воска. Если подозревается спаривание, обследование самца шиншиллы может предоставить дополнительные показания; будет замечено увеличение объема яичек в дополнение к обнаружению кольца из меха вокруг полового члена, известного как «волосяное кольцо», которое следует удалить с особой осторожностью (рис. 3 и 4).
Рис. 3. Пенис шиншиллы с волосяным кольцом
Рис. 4. Волосяное кольцо, после снятия
Шиншиллы, как и другие грызуны (морская свинка), соглашаются на спаривание в течение 48 часов после родов, с высоким процентом беременности.
Приблизительно через 57,4 ± 2,6 дня после родов у самки шиншиллы начнется течка, и возможна дальнейшая попытка спаривания.2
Беременность
В ранних описаниях дикой шиншиллы считалось, что эти животные рожали щенков в количестве от 5 до 7; сегодня количество щенков у шиншилл, рождающихся в дикой природе и разводимых в неволе, одинаково. У диких самок шиншилл, пойманных в течение последнего месяца беременности, рождалось 1,8 щенков на беременность, эта цифра очень похожа на полученную для племенных животных, 2 - 3 на беременность, 2 со средним значением 2 для длиннохвостой шиншиллы и 1,4 для короткохвостой шиншиллы. 3
Что касается продолжительности беременности, существуют заметные различия в зависимости от рассматриваемого вида шиншиллы. Действительно, короткохвостая шиншилла имеет период беременности 128 дней;26 длиннохвостая имеет период беременности 111 дней. 26 У гибрида двух этих видов наблюдается промежуточное время беременности, около 115 дней.3
Обычно шиншилла, как домашняя, так и дикая, успешно совершает 2 беременности в год, и даже 3 беременности в год могут быть возможны при интенсивном разведении.
ЦЕННОСТИ ФЕКАЛЬНОГО ПРОГЕСТЕРОНА И ЭСТРОГЕНОВ ПРИ ИНТЕНСИВНОМ РАЗВЕДЕНИИ ШИНШИЛЛ
Для настоящего исследования 24 небеременных шиншиллы (C.laniger var La Plata) были выбраны случайным образом и разделены на 3 группы (группа A; группа B; группа C). Группа A (Таблица 1) и группа B (Таблица 2), состоящие из 10 шиншилл каждая, находились под наблюдением в течение осеннего сезона (группа A) и в течение весеннего сезона (группа B). Образцы фекальных гранул этих животных отбирали для дозировки фекальных метаболитов прогестерона и мазков из влагалища для выявления фаз цикла эструса. Группу С (Таблица 3), состоящую из 4 субъектов, наблюдали в течение осеннего сезона, и у этих животных отбирали гематологические пробы для количественной оценки дозировки прогестерона и эстрогена в дополнение к тестам мазка из влагалища для индивидуального определения фазы цикла эструса. Все особи различались по возрасту от 1 до 4 лет, с весом приблизительно 547±63 г. Все наблюдаемые животные не имели патологических отклонений в развитии.
Таблица 1
Значения фекального прогестерона, полученные во время осеннего сезона (группа А)
Сбор фекального материала и выполнение вагинального мазка
В ходе исследования было отобрано 10 образцов кала для каждого отдельного животного (1 раз в 3 дня) в нерепродуктивном периоде (группа А) и в репродуктивном периоде (группа В). Влагалищные мазки были своевременно нанесены на предметные стекла и окрашены по Харрису-Шорру (рис. 5).
Осенний сезон
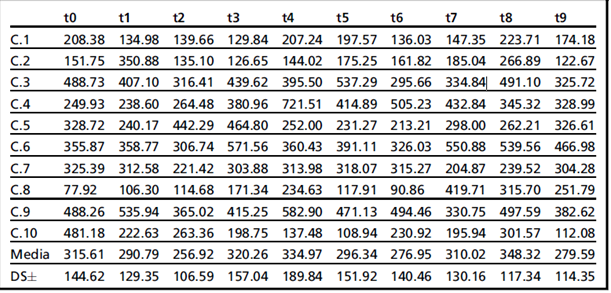
Значения фекального прогестерона у всех животных в группе А в разное время, полученные в течение осеннего сезона, приведены в таблице 1.
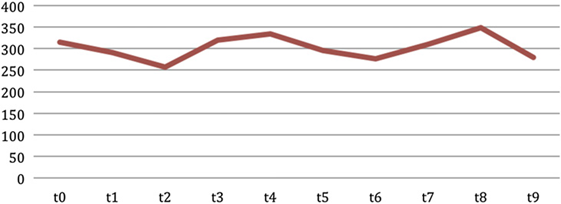
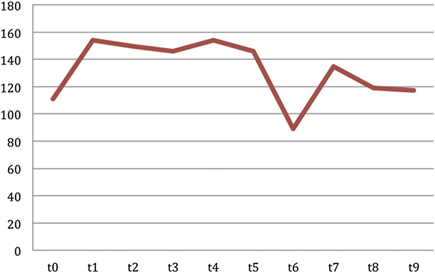
Средние значения прогестерона у всех животных в разное время представлены на рис. 6. График показывает тренд прогестерона в течение периода сбора со средним значением и стандартным отклонением 302,98±28,13 нг/г и диапазоном, который варьируется от минимального значения 256,92 нг/г до максимального значения 348,32 нг/г. Самая низкая абсолютная величина была 77,92 нг / г, а самая высокая абсолютная величина была 721,51 нг / г.
У этих животных было невозможно распознать общий T0, который давал возможность узнать обо всех животных в «одинаковой» гормональной ситуации (аналогично тому, что происходило вместо этого у тех, которые наблюдались в течение весеннего сезона). Фактически, в течение всего периода ни одно из животных не проявляло изменений, которые типичны для эструса (открытие вагинальной щели и присутствие вязкой слизи), и только у 1 животного (C.8) были замечены хоть какие-то изменения, выраженные в отслоении клеток влагалища, относящиеся, возможно, к «тихой течке»;3 в частности, кольпоцитологическое изображение показало увеличение популяции клеток и чешуек, несмотря на большое количество нейтрофилов и небольшое присутствие других типов клеток.
Таблица 2.
Прогестерон и эстрогены в течение осеннего сезона
Животное Прогестерон (нг/г) Эстроген (пг/мл)
Таблица 3.
Значения фекального прогестерона, полученные во время весеннего сезона (группа B)
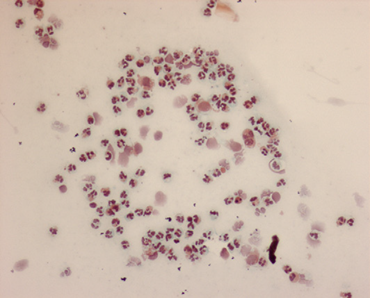
Результаты кольпоцитологии, полученные в осенний период, показали очень похожую картину: популяция доминантных клеток была постоянной по сравнению с популяцией нейтрофилов, сопровождаемой другими клеточными популяциями, в частности, парабазальными клетками и небольшими интермедиатами (рис. 7 и 8). Это связано с «метаэструсом», описанным Bekyruerek и его коллегами 27,28, и «диэструсом», описанным Gromadzka-Ostrowska и Szylarska-Gozdz. 10
Данные с высокими значениями, полученные для фекального прогестерона группы A, были подтверждены следующей величиной гематического прогестерона группы C. Полученные данные представлены в таблице 2.
Эти данные установили наличие высоких концентраций прогестерона, но не подтверждены в литературе. Некоторые авторы действительно утверждают, что уровень прогестерона в сыворотке крови в осенний период засвидетельствован на уровне 5,29 ±0,70 нг / мл.10
Рис. 5. Получение вагинального мазка для кольпоцитологии.
Рис. 6. Среднее значение фекального прогестерона в течение осеннего периода.
Низкие значения эстрогена по сравнению с высокими значениями прогестерона подтверждают, что у животных в момент отбора проб не было анэструса, а была фаза диэструса.
В дополнение к гематическим образцам были взяты вагинальные мазки, чтобы связать гематические концентрации прогестерона с кольпоцитологией. Из этого получилось изображение, похожее на полученное в предыдущей выборке. Отслоившиеся клетки влагалища характеризовались преобладанием нейтрофилов и присутствием следов других клеточных рядов (цитологический диэструс).
Весенний сезон
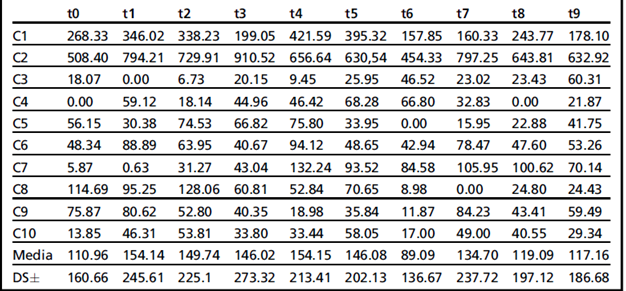
Значения фекального прогестерона у всех животных в группе B в разное время, полученные в течение весеннего сезона, приведены в таблице 3.
Средние значения прогестерона у всех животных в разное время представлены на рис. 9. График показывает тренд прогестерона, в течение всего месяца периода сбора, со средним значением и стандартным отклонением 132,11± 22,03 нг / г, в диапазоне от 89,09 нг / г до 154,15 нг / г. Затем, если не учитывать животных С.1 и С.2, у которых значения прогестерона были явно выше, чем у других, наблюдавшихся в то же время, то значения составляли 46,80±7,47 нг/г с диапазоном между 34,84 нг/г и 57,91 нг/г. Очевидно, что самое низкое значение составляло 0,00 нг / г, тогда как самое высокое значение составляло 910,53 нг / г (с учетом животных С.1 и С.2); если вышеупомянутые животные не были приняты во внимание, то самое высокое значение составило 114,69 нг/г.
Рис. 7. Метаэструс/диэструс в течение осеннего сезона (Harris-Shorr х20).
Рис. 7. Метаэструс/диэструс в течение осеннего сезона (Harris-Shorr x40).
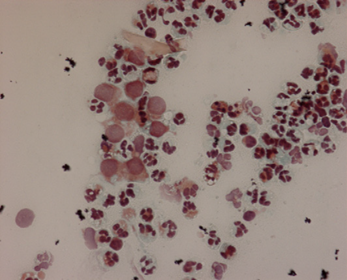
У животных, наблюдаемых в течение весеннего сезона, можно было сравнить значения прогестерона, как если бы все они находились в одном и том же гормональном моменте. Действительно, благодаря диагностической помощи кольпоцитологии, автор смог в момент времени 0 сообщить обо всех предшествующих моментах, которые показали "цитологическую" течку. У 8 из 10 животных можно было наблюдать типичные изменения «характерные» для эструса в виде отслоившихся влагалищных клеток: они, как описано Bekyuerek и его коллегами в 2002 г., являются характеристикой доминирования поверхностных клеток и чешуек. (Рис. 10).
Результаты кольпоцитологического теста показали, что у 2 субъектов (С.3 и С.4) проявлялось больше цитологических эструсов в течение весеннего периода. В частности, шиншилла С.3 показала 2 эструса с интервалом в 21 день; шиншилла С.4 показала 2 эструса с интервалом в 24 дня.
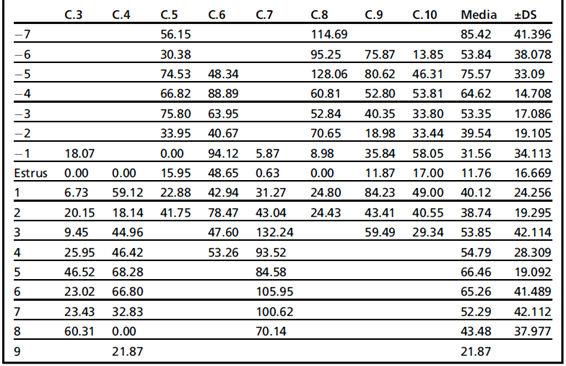
Значения фекального прогестерона, сравниваемые при цитологическом T0, приведены в таблице 4. Значения фекального прогестерона у животных, у которых был «цитологический» эструс, представлены красным цветом. Как объяснялось ранее, животные C.3 и C.4 продемонстрировали 2 цитологических эструса в течение контролируемого периода. Из значений, полученных во время цитологического эструса, можно сделать вывод, что не у всех животных был представлен базальный уровень прогестерона.
Рис. 9. Среднее значение фекального прогестерона в течение весеннего сезона.
Рис. 10. «Цитологический» эструс в течение весеннего периода (Harris-Shorr x40).
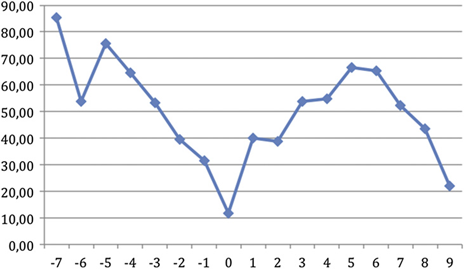
Перенеся эти значения на график, где T0 соответствует цитологическому эструсу, стало возможным представить циклическую тенденцию прогестерона в течение весеннего периода (рис. 11).
Значения прогестерона у животных С.1 и С.2 не включены в график, поскольку кольпоцитология, полученная для этих субъектов, выявила картину, которая соотносится с ситуацией длительного метаэструма/диэструма, совместимую с высокими значениями прогестерона.
Таблица 4.
Значения фекального прогестерона, наблюдаемые в цитологический эструс
Рис. 11. Тенденция фекального прогестерона в течении циклической активности шиншиллы, где 0 – соответствует цитологическому эструсу.
РЕЗЮМЕ
Мониторинг репродуктивного цикла с использованием кольпоцитологии и содержания фекального прогестерона представляет собой эффективный метод для понимания репродуктивной физиологии рассматриваемых видов.
Основываясь на доказательствах в виде полученных данных, тест мазка из влагалища является незаменимым помощником в мониторинге различных фаз цикла эструса. Используя кольпоцитологическое исследование, автору удалось идентифицировать фазу течки, которую животное проявляло в любой определенный момент времени. Это не только позволило подтвердить изменения фекального прогестерона, полученные в разные периоды испытаний, но так же с помощью этого метода стало возможным получение данных «цитологического» эструса у тех животных, которые не имели характерных для этих видов проявлений. На самом деле, в настоящее время неизвестно, может ли шиншилла забеременеть после спаривания во время «тихой» течки. В частности, цитологический эструс наблюдался у животных (у шиншиллы 8 в осенний период; у шиншилл 1 и 2 в весенний период), которые имели высокие значения фекального прогестерона и не имели анатомических изменений, относящихся к эструсу (открытие вагинальной щели и наличия слизи). Фактически, как и было описано Grau,3 у 3 шиншилл могли проявляться «тихие» течки, которые не сопровождаются открытием вагинальной щели, особенно в неблагоприятные месяцы спаривания. Автор считает, что отсутствие характерных признаков эструса обусловлено высокими значениями прогестерона; однако это заключение должно быть исследовано дополнительно.
Было также показано, что кольпоцитология полезна при определении периода интерэструса весной; автор фактически наблюдал, что у 2 животных (шиншиллы 3 и 4, репродуктивный сезон) было больше цитологических эструсов в течение контролируемого периода. В частности, у шиншилл 3 и 4 были обнаружены 2 цитологических эструса с периодами 21 и 24 дня соответственно. Эти сведения подтверждают данные, приведенные Gromadzka-Ostrowska и Sylarska-Gozdz 10 о том, что в весенний сезон шиншилла имеет переменный цикл от 22 до 27 дней.
Образцы, взятые с использованием фекалий, имеют многочисленные преимущества: фекалии легко собрать, и, что более важно, у этого типа животных повторный отбор проб может быть выполнен без беспокойства животного из-за сложности и осложнений при взятии пробы крови. Кроме того, было бы невозможно контролировать эндокринную ось в течение длительного периода времени с использованием отбора проб крови из-за большого объема необходимой крови.
С помощью этого метода животных наблюдали в течение достаточно длительного периода во время осеннего сезона и в течение весны. В течение осеннего сезона были получены неожиданные результаты. Многие авторы сообщают, что шиншилла является сезонным животным с положительным фотопериодом, и в период от лета до осени она находится в анэструсе.16,21,22,28-32 Фактически, полученные значения прогестерона находились в резком контрасте с тем, что было заявлено в ранних обсуждениях. Действительно, по данным автора, у шиншиллы очень высокий уровень прогестерона в течение осеннего сезона (в среднем 302,98 и 28,14 нг / г), что не соответствует анэструсу. Результаты автора, с другой стороны, подтверждают работу Gromadzka-Ostrowskka и Sylarska-Gozdz 10, которые утверждают, что в период от осени до зимы шиншиллы имеют цикл от 70 до 90 дней.
Из-за продолжительности тестируемого периода последний установленный факт не может быть подтвержден, и его следует тщательно изучить в ходе длительного мониторинга (> 90 дней) репродуктивной оси животного. Однако на основе полученных данных можно сделать вывод, что шиншилла не проявляет активности сезонного типа, но демонстрирует непрерывный цикл, в котором изменяется фаза диэструса. Фактически, полученные данные доказывают, что шиншилла находится в фазе длительного диэструса в осенний период, в соответствии как со значениями прогестерона, так и с кольпоцитологическими исследованиями. Было бы чрезвычайно интересно более подробно изучить этот вопрос, чтобы понять, какой элемент определяет удлинение периода диэструса.
В заключение можно утверждать, что шиншилла проявляет репродуктивную активность непрерывного типа и что увеличение количества спариваний в течение весеннего сезона обусловлено более коротким периодом диэструса, и, как следствие, животные демонстрируют более короткий цикл с более частым эструсами.
ИСТОЧНИКИ ЛИТЕРАТУРЫ
1. Weir BJ. Aspect of reproduction in the chinchilla. J Reprod Fertil 1966;12: 410 1.
2. Quesenberry KE, Carpenter JW. Ferrets, rabbits and rodents: clinical medicine and surgery. 2nd edition. St Louis (MO): Saunders; 2004. p. 243–59.
3. Grau J. La chinchilla, su crianza en todos los climas. El Ateneo; 1993.
4. Bonagura JD. Terape´utica veterinaria de pequen˜os animales. McGraw-Hill Interamericana; 2001.
5. Brookhyser KM, Aulerich RJ. Consumption of food, body weight, perineal colour and levels of progesterone in the serum of cyclic female chinchillas. J Endocrinol 1980;87:213–9.
6. Busso JM, Ponzio MF, Fiol De Cuneo M, et al. Noninvasive monitoring of ovarian endocrine activity in the chinchilla (Chinchilla lanigera). Gen Comp Endocrinol 2007;150(2):288–97.
7. Busso JM, Ponzio MF, Fiol De Cuneo M, et al. Reproduction in chinchilla (Chinchilla lanigera): current status of environmental control of gonadal activity and advances in reproductive techniques. Theriogenology 2012;78(1): 1–11.
8. Cabrera A. Catalogo de los mamıferos de America del sur. Parte II revista del museo argentino de ciencias naturales bernardino rivadavia. Zoologia 1961; 4(2):309–732. Sexual Hormone Fluctuation in Chinchillas 207
9. Caliskaner S. Kurk hayvanlarinin beslenmesi. Ankara (Turkey): Ders kitabi: 376; 1993. p. 190–9.
10. Gromadzka – Ostrowska J, Szylarska – Gozdz E. Progesterone concentration and their seasonal changes during the estrus cycle of chinchilla. Acta Theriol 1984;29(20):251–8.
11. Wessel K. Does light affect reproduction in chinchillas too. Der Deutsche Pelztierzuchter 1963;37:91–3.
12. Celiberti S, Robbe D, Tosi U, et al. Monitoraggio del ciclo riproduttivo nel cincilla` (Chinchilla Lanigera) mediante colpocitologia e dosaggio del progesterone fecale. Atti SIRA 2010;8:205–8.
13. Czekala NM, Lasley BL. A technical note on sex determination in monomorphic birds using fecal steroid analysis. Int. Zoo Yearb 1977;17:209–11.
14. D’elia G, Teta P. Chinchilla lanigera. In: IUCN 2010. IUCN Red List of Threatened Species. 2008.
15. Fowler ME, Miller RE. Zoo and wild animal medicine. 5th edition. St Louis (MO): Saunders; 2003. p. 420–42.
16. Weir BJ. Chinchilla. In: Hafez ES, editor. Reproduction and breeding techniques for laboratory animals. Philadelphia: Lea and Febiger; 1970. p. 209.
17. Schwarzenberger F, Mostl E, Palme R, et al. Faecal steroid analysis for noninvasive monitoring of reproductive status in farm, wild and zoo animals. Anim Reprod Sci 1996;42:515–26.
18. Spontorno AE, Zuleta JP, Deane AL, et al. Chinchilla Laniger. Mamm Species 2004;758:1–9.
19. Tam WH. A comparative study of the production of progesterone by various hystricomorph rodents. J Endocrinol 1970;48:18–9.
20. Tappa B, Amao H, Takahashi KW. A simple method for intravenous injection and blood collection in the chinchilla (Chinchilla laniger). Lab Anim 1989;23:73–5.
21. Puzder M, Novikmec J. The principal reproductive indices in Chinchilla Laniger. Veterinarstvi 1992;42:258–9. 22. Thiede MR. Chinchillas als heimtiere, richting pflegen und verstehen. 3 Auflage. Munchen (Germany): Tyodata GmbH; 1994. p. 43–7.
23. Weir BJ. The induction of ovulation and oestrus in the chinchilla. J Reprod Fertil 1973;33:61–8.
24. Weir BJ. Reproductive characteristics of hystricomorph rodents. Symp Zool Soc Lond 1974;34:265–301.
25. Weir BJ, Rowlands IW. Functional anatomy of the hystricomorph ovary. Symp Zool Soc Lond 1974;34:302–32.
26. Gabrisch K, Zwart P. Medicina e chirurgia dei nuovi animali da compagnia, vol. II. Torino (Italy): UTET Ed; 2001. p. 173–96.
27. Adaro L, Orostegui C, Olivares R, et al. Variaciones morfome´ tricas anuales del sistema reproductor masculino de la chinchilla en cautiverio (Chinchilla Laniger Grey [sic]). Avances en Produccio´n Animal 1999;24:91–5.
28. Bekyu¨rek T, Liman N, Bayram G. Diagnosis of sexual cycle by means of vaginal smear method in the chinchilla (chinchilla lanigera). Lab Anim 2002;36(1): 51–60.
29. Jakubow K, Gromadzka – Ostrowska J, Zalewska B. Seasonal changes in the haematological indices in peripheral blood of chinchilla (Chinchilla laniger L.). Journal of Small Exotic Animal Medicine 1984;78(4):845–53.
30. Jimenez JE. The extirpation and current status of Chinchilla lanigera and C. brevicauda. Biol Conserv 1996;77:1–6. 208 Celiberti et al
31. Kuroiwa J, Imamichi T. Growth and reproduction of the chinchilla-age at vaginal opening, oestrus cycle, gestation period, litter size, sex ratio and diseases frequently encountered. Jikken Dobutsu 1977;26:213–22 [in Japanese].
32. Munoz-Pedreros A. Orden rodentia. In: Munoz-Pedreros A, Yanez J, editors. Mamıferos de Chile. Valdivia (Chile): Ediciones Centro de Estudios Ambientales; 2000. p. 73–126.
Simone Celiberti, DVMa, Alessia Gloria, DVM, PhDb,*,
Alberto Contri, DVM, PhDb, Augusto Carluccio, DVM, PhDb,
Tanja Peric, DScAc, Alessandro Melillo, DVMa,
Domenico Robbe, DVM, PhDb
Перевод на русский язык: В.В. Дадижа
Редакция: Д.В. Михайлов
S. Celiberti, A. Contri, A. Carluccio, T. Peric, A. Melillo, D. Robbe. Sexual Hormone Fluctuation in Chinchillas (Колебания половых гормонов у шиншилл) // Vet Clin Exot Anim 16 (2013) 197–209