Длиннохвостая шиншилла (Chinchilla laniger)
Chinchilla Bennett, 1829
Mus: Molina, 1782:301. Part, not Mus Linnaeus, 1758.
Lemmus: Tiedemann, 1808:476. Part, not Lemmus Link, 1795.
Cricetus: È. Geoffroy St.-Hilaire, 1803:197. Part, not Cricetus Leske, 1779.
Chinchilla Bennett, 1829:1. Type species Mus laniger Molina, 1782, by monotypy.
Eriomys Lichtenstein, 1830: plate 28. Type species Eriomys chinchilla Lichtenstein, 1830, by monotypy.
Callomys d’Orbigny and I. Geoffroy Saint-Hilaire, 1830:289. Part, no type species selected.
Aulacodus: Kaup, 1832: column 1211. Not Aulacodus Temminck, 1827:245.
Lagostomus: Cuvier, 1830: plate 64. Not Lagostomus Brookes, 1828.
Объем и ранг
Rodentia, подотряд Hystricognatha (Caviomorpha), надсемейство Chinchilloidea, семейство Chinchillidae, подсемейство Chinchillinae. Чилийская шиншилла считалась одним из трёх подвидов Chinchilla chinchilla (например, Osgood 1943), но самые последние авторы выделяют два вида шиншилл, C. laniger и C. brevicaudata (Cabrera 1961; Corbet and Hill 1980; Munoz-Pedreros 2000, Woods 1993), что совпадает с последними молекулярными данными (Spotorno et al., 2004). Вальядарес и Споторно (2003) подали прошение в Международную комиссию по зоологической номенклатуре для установления конкретных названий Mus laniger Molina, 1782 и Eriomys chinchilla Lichtenstein, 1830 для этих двух видов, но прошение ещё не опубликовано, и Комиссия не вынесла своего решения.
Chinchilla laniger (Molina, 1782) (чилийская шиншилла) (далее длиннохвостая шиншилла – прим. пер.)
Mus laniger Molina, 1782:301. Тип местности ‘‘Provincie Boreali del Chili,’’ [северные провинции Чили]; ‘‘Coquimbo’’ согласно Osgood (1943:134).
Cricetus laniger: È . Geoffroy St.-Hilaire, 1803:197. Комбинированное название. L[emmus]. laniger: Tiedemann, 1808:476. Комбинированное название.
C[ricetus]. chincilla Fischer, 1814:55. Тип местности «Chile borealibus», основано на Mus laniger Molina, 1782.
Chinchilla lanigera Bennett, 1829:1. Первое использование текущего комбинированного названия и неправильного последующего написания. Mus laniger Molina, 1782.
Callomys laniger: d’Orbigny and I. Geoffroy Saint-Hilaire, 1830: 289. Комбинированное название.
Lagostomus laniger: Cuvier, 1830: plate 64. Комбинированное название.
Aulacodus laniger: Kaup, 1832: column 1211. Комбинированное название.
Chinchilla velligera Prell, 1934:100. Переименование Mus laniger Molina, 1782.
Объем и ранг
Объем соответствует виду. Chinchilla laniger является монотипическим видом.
Диагноз
Размер тела Chinchilla laniger (рис.1) меньше (<260 мм), чем размер Chinchilla brevicaudata (>320 мм), она имеет более округлые уши (длина >45 мм) и более длинный (>130 мм) пушистый хвост (Redford and Eisenberg 1992), чем у C. brevicaudata (<32 мм и <100 мм соответственно). Число каудальных позвонков составляет 23 у C. laniger и 20 у C. brevicaudata (Grau 1986).
Основные характеристики
Дикие чилийские шиншиллы из национального заповедника Las Chinchillas в Ауко имеют меньший размер и проявляют меньший половой диморфизм, чем одомашненные животные: вес самцов составляет (в среднем ± СКО, если не указано иное) 412±9 г (диапазон, 369-493 г, n=15), вес самок 422±7 г (диапазон, 379-450 г, n=14, Jimenez 1990a). Самки в неволе весят до 800 г, тогда как самцы достигают 600 г (Neira et al., 1989).
Шерсть длиной 2-4 см, имеет серые, белые и черные полосы (зональность окраса, прим. пер.); она шелковистая, чрезвычайно мягкая и плотно прилегает к коже (Bennett 1835); по этой причине мех шиншиллы считается коммерчески ценным (Cortes et al., 2000; Seele, 1968). Из одного волосяного фолликула вырастает множество волосков (50-75). Пуховые волосы диаметром 5-11 мкм сгруппированы в 2 боковых кластера. В центре каждого кластера находится один направляющий волос диаметром 10-15 мкм. Вибрисс много, они крепкие, длинные (100-130 мм) и растут из отдельных фолликулов (Wilcox 1950).
В целом окраска верхней части тела синеватая или серебристо-серая, нижней части желтовато-белая. Хвост на дорсальной поверхности имеет длинные грубые серые и черные волосы длиной 30-40 мм вблизи тела и 50-60 мм около кончика (Albert 1900). Эти волосы образуют щетинистый пучок, находящийся на 50 мм выше позвоночника (Bennett 1835)
Голова широкая, с округлыми большими ушами (45-48 мм, в среднем 46,7, n=3), покрытыми мельчайшими волосками. Череп (рис.2) имеет весьма расширенные слуховые буллы, которые выступают над верхней его поверхностью. Передние конечности гораздо меньше задних (Yarrell 1831). Берцовая кость длиннее бедренной, малоберцовая кость фактически отсутствует (Schaeffer and Donnelly 1997). Короткие передние лапы имеют 5 пальцев, а узкие задние - 3 пальца плюс 1 рудиментарный, имеющий жесткие щетинки, окружающие небольшой плоский коготь. Имеются другие когти, но они очень короткие.

Рис. 1. Фотография взрослого самца длиннохвостой шиншиллы, пойманного на границе Национального заповедника Las Chinchillas, Ауко, Ильяпель, IV регион, Чили (образец коллекции лаборатории цитогенетики медицинского факультета университета Чили 400). Фотография A. Spotorno O. (1975).
Распространение
Дикие популяции длиннохвостых шиншилл встречаются в Ауко вблизи Ильяпеля, IV регион Чили (31°38' ю.ш., 71°06' з.д.) в национальном заповеднике Las Chinchillas (рис. 3) и в Ла-Игуэра, примерно в 100 км севернее Кокимбо (29°33' ю.ш., 71°04' з.д. Jimenez, 1996). О наличии чилийских шиншилл сообщалось из Тальки (35°30' ю.ш.), Чили, и севернее вплоть до Перу (Беннетт 1835), а также восточнее прибрежных холмов на низких горных склонах Чили. К середине XIX века чилийские шиншиллы не встречались южнее реки Чоапа (32° ю.ш. Gay 1847, Jimenez 1990a,b). Ошибочно сообщалось, что они селились и далее на юге, до 52° ю.ш. (Walker 1968). Об ископаемых останках шиншилл ничего неизвестно.
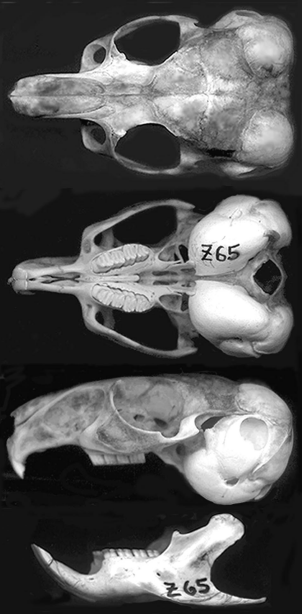
Рис. 2. Дорсальные, вентральные и латеральные виды черепа, а также латеральный вид нижней челюсти зрелой самки длиннохвостой шиншиллы из Ауко, Ильяпель, IV Регион, Чили (образец Z65, коллекция университета de La Serena, Чили). Наибольшая длина черепа составляет 59 мм.

Рис. 3. Историческое (приблизительно 18 в.) географическое распространение вида Chinchilla laniger (модифицированный материал Grau [1986]). Звездами обозначены места ныне известных диких популяций (Jimenez 1996): Ла Игуэра, Кокимбо и Ауко, Ильяпель, Чили.
Внешний вид
Эпидермис взрослых домашних шиншилл имеет 3 различимых слоя: двухклеточный stratum germinativum (базальный слой), одноклеточный stratum granulosum (зернистый слой) и толстый stratum corneum (роговой слой). Между последними двумя не был обнаружен stratum lucidum (блестящий слой) (Wilcox 1950).
Каждая группа волос имеет одну выпрямляющую мышечную фимбрию. Направляющие волосы имеют свои сальные железы, тогда как 3 или 4 другие железы обслуживают все волосы боковой группы. Отдельные волосы встречаются в виде вибрисс или на хвосте и ушных раковинах. Фолликулярная слоистость встречается только в вибриссах (Wilcox 1950).
Самки имеют 2 пары грудных и 1 пару паховых молочных желез (Weir 1974), хотя у диких особей последние не видны. Во время лактации область вокруг молочной железы лишена шерсти.
Череп относительно широкий, с небольшим гребнем или без него. Инфраорбитальный канал очень крупный, без отдельной бороздки для прохождения нерва; у его переднего края слезный канал имеет большое отверстие со стороны рострума. Пароокциптальный выступ (отросток затылочной кости) короткий и связан с буллой, скуловой выступ подходит близко к слёзному каналу (Lawlor 1979). Коэффициент энцефализации для домашних животных (отношение фактической массы мозга к средней прогнозируемой массе тела для млекопитающего данного размера) равен 1.342 (Eisenberg 1981). Гипофиз составляет 3,46 мг /% от массы тела у самцов и 4,02 мг /% у самок (Asdell 1964).
Слуховые буллы имеют 3 крупных везикулярных выпуклости; верхняя выпуклость по форме близка к полусфере, задняя - продолговатая, нижняя - грушевидная (Bennett 1835). Средний общий объем среднего уха составляет 1,52 мл ± 0,26 СКО (n=9 Vrettakos et al., 1988). Тимпаническая мембрана почти параллельна медиальной стенке наружного слухового прохода и крепится к костному кольцу; максимальный диаметр составляет 8,53 мм ±0,18 СКО, минимальный диаметр равен 8,32±0,27 мм (n = 5), окружность 26,47 ± 0,65 мм высота конуса 1,78 ± 0,22 мм (n = 5). Площадь тимпанической плоскости составляет 55,64 мм2 ± 2,7 СКО, однако с учетом её конической формы средняя площадь увеличивается на 9% и составляет в среднем 60,44 ± 2,3 мм2 (n=5). В оссикулярной цепи инкудомалеолярный сустав имеет слитную структуру, а 2 косточки образуют изогнутую полоску, плотно прилегающую к эпитимпаническому углублению. Рукоятка молоточка и задняя сторона переднего отростка наковальни перпендикулярны оси вращения. Площадка стремечка нижней частью ориентирована назад, ножка более центрирована, чем у людей и мышей. У взрослых чилийских шиншилл нет стременных артерий. Общая длина стремечка от поверхности основания до инкудостапедиального сустава составляет 1,78 мм, средняя масса 0,4 мг ± 0,3 СКО (n = 6). Диаметры овального окна 2,19 и 0,78-0,93 мм. Круглое окно имеет овальную форму, диаметры 1,40 и 0,95 мм. Боковой отросток наковальни и ямка наковальни скреплены связками, так же, как и 3 других косточки. Tensor Tympani (мышца, напрягающая барабанную перепонку) и мускулатура стремечка хорошо развиты (Vrettakos et al. 1988).
Слизистая оболочка среднего уха состоит из столбчатого, кубического и сквамозного эпителия. Евстахиева труба выстлана ресничным псевдостратифицированным столбчатым эпителием. Плотность ресничных клеток наиболее высока в столбчатой области эпителия переходной зоны. Плотность секреторных клеток наиболее высока в глоточном отверстии (Hanamure and Lim 1987).
Зубы - гипсодонты и непрерывно растут (корни отсутствуют). Ряды верхних зубов сходятся впереди, коронки щечных зубов плотные, состоят из группы поперечных пластин (Bennett 1835). Зубная формула i 1/1, c 0/0, p 1/1, m 3/3, всего 20. Резцы вырастают на 5-7,5 см в год. Эмаль у здоровых животных обычно имеет темно-желтый цвет (Hillyer et al., 1997); некоторая часть внутренней радиальной эмали закрыта дентин-эмалевым соединением, так же, как и portio externa (Von Koenigswald 1985).
Нижняя челюсть не имеет гребня или углубления на боковой поверхности; угловой отросток удлинен и не дефлектирован. Мыщелок небольшой и вытянутый, гленоидальная впадина неглубокая, что позволяет осуществлять движение как вперед, так и назад.
Позвоночная формула 7 C, 13 T, 6 L, 2 S, 23 Ca, всего 51 (Bennett 1835), имеется 13 пар ребер (Yarrell 1831). Лучевая и локтевая кости, хотя и отделены, но настолько тесно совмещены на конце запястья, что выглядят неподвижными на половину своей длины. Межсуставной хрящ между ключицей и грудиной длиной около 6 мм.
Жевательная мышца разделена на три части. Поверхностная часть берет начало из сильного сухожилия с вентральной стороны скуловой кости ниже подглазничного отверстия и размещена вдоль вентрального края угла челюсти. Боковая часть возникает из скуловой кости и включений на вентральной части жевательной ямки и вентральном краю мандибулы. Углублённая часть также имеет разделение на несколько частей: передняя углублённая часть берёт начало от дорсальной части верхнечелюстной части морды и проходит назад и вниз через большое подглазничное отверстие; задняя углублённая часть начинается от вентральной поверхности скуловой кости и располагается вдоль дорсальной половины жевательной ямки. Gluteus medius увеличен. Височная мышца сокращена и не дифференцирована.
Сердце у домашних животных более вытянуто и скруглено на верхушке, по сравнению с почти квадратным сердцем вискаш (Lagidium). Внутренняя сонная артерия отсутствует, кровоснабжение головного мозга осуществляется только с помощью вертебро-базилярной артериальной системы. При этом система наружной сонной артерии берет на себя полное кровоснабжение стременной площадки при помощи 3 анастомозов; внутренняя глазная артерия блокирована (Bugge 1984). Артериальное орошение яичек и эпидидимиса происходит при помощи семенниковых артерий; вспомогательные половые железы и каналы отводят орошение от внешней подвздошной артерии (Adaro et al. 1998).
Лёгкие асимметричны, имеют 3 доли в левой части и 4 доли в правой; нижняя доля наибольшая по размеру, глубокая – двунаправленная. Трахея овальная при поперечном разрезе, имеет кольца, не завершена дорсально (Bennett 1835).
Орган Якобсона представляет собой пару трубчатых структур длиной около 6 мм, расположенных в двух направлениях вдоль основания носовой перегородки. Его сенсорный эпителий состоит из обонятельных, поддерживающих и базальных клеток. Ацинарные клетки органа Якобсона в респираторном эпителии имеют 2 типа секреторных гранул. Первый – гомогенные гранулы, около 1700 нм в диаметре, второй – около 2200 нм в диаметре с варьирующейся плотностью электронов (Oikawa et al. 1994).
Полость рта небольшая и узкая. Ротоглотка сообщается с глоткой небным отверстием (Hillyer et al. 1997). Желудок грушевидной формы, длина 63 мм, наибольшая ширина слева - 44 мм, средняя - 25 мм (Bennett 1835). Пищевод входит примерно в середину его полости, пилорическая часть формирует направленную вверх кривизну, на которой начало двенадцатиперстной кишки совершает резкий поворот. Печень имеет 4 доли: 2 больших и 2 малых (Yarrell 1831), с глубокой пузырной бороздой и хвостатой долей. Селезенка имеет длину 25 мм и ширину 22 мм на нижней оконечности.
Тонкий и толстый кишечник у одной взрослой домашней особи имели длину 350 см (Hillyer et al., 1997). У дикого экземпляра общим размером около 21 см общая длина тонкого кишечника составляла ок. 117 см, толстого кишечника без учёта слепой кишки - 145 см. Двенадцатиперстная кишка опускается до поясничной области справа, затем поворачивает вверх, пересекая позвоночник, и далее становится свободной. Относительно большая скрученная в кольцо слепая кишка (Hillyer et al., 1997) занимает левую подвздошную область и имеет слепой конец, скрытый за первой складкой (Bennett 1835). Ободочная кишка изгибается вверх и далее влево, затем дважды резко поворачивает, вновь поворачивает (уже менее резко) и опускается в гипогастрий. Она поднимается в подреберную область, где прикрепляется к двенадцатиперстной кишке брюшиной, а затем возвращается обратно, опускаясь вниз длинной двойной свободной складкой длиной около 23 см. Формирование болюсов начинается в этой длинной складке (Bennett 1835).
Почки имеют длину 19 мм и ширину 13 мм. Почечная капсула имеет вид продолговатого белого тела, медиально направлена к верхней части почки и имеет длину около 12 мм (Diaz and Cortes 2003).
Репродуктивная система самок включает 2 рога матки и 2 шейки (Weir 1970). Яичник яйцевидный и свисает от дорсальной стенки брюшной полости до мезовариума. Фаллопиевы трубы свисают на брыжейке, которая частично может окружать яичник, формируя очень тонкую и слабо заметную яичниковую сумку. Фимбрии не выступают. Кровеносные сосуды и нервы входят в яичники вдоль краниальной части мезовариума, хилус крупный и хорошо заметен. Поверхность яичника гладкая, фолликулы могут быть полупрозрачными, но редко выглядят как выступающие на поверхности выпуклости. Стигма не выступает на поверхности, жёлтое тело невидимо; по этой причине овуляцию трудно обнаружить спустя несколько дней (Weir and Rowlands 1974). Полиовуляционные фолликулы очень часто встречаются при родах, 61% рожденных животных имеют от 0,4 до 19% таких фолликул.
Семенники сравнительно большие. Выборка из 4 диких зрелых самцов имела длину семенников 21-29 мм (в среднем 26,2 мм), массу 3,0-5,1 г (в среднем 4,3 г). C. laniger не имеет истинной мошонки; вместо этого семенники находятся в паховом канале, а эпидидимис может каудально опускаться в небольшие подвижные постанальные мешочки. Паховой канал открыт (Weir 1970).
Вспомогательные репродуктивные железы у домашних самцов включают большие бульбоуретральные железы (средний диаметр ± СКО = 6,4 ± 0,16 мм, n = 50), которые окружены оболочкой из плотной соединительной ткани и поперечнополосатой мускулатуры с волокнами, расположенными в трёх измерениях (Cepeda et al. 1999). Внешний вид простаты варьируется (Adaro et al., 1999; Weir 1974). Большие везикулярные железы обеспечивают основную часть секреции вспомогательных желез. Получающиеся в результате флюидные гелеобразные вещества образуют копуляционную пробку у самок (Weir 1974).
Пенис отделен от ануса кожей, лишённой шерсти (Weir 1974). Головка полового члена частично покрыта небольшими остистыми волосками простого строения, направленными к телу. Вентральный уретральный мешочек размером 7 мм или приспособленный для введения мешочек пениса с небольшими остистыми волосками, направленными от тела, находятся ниже мочеиспускательного канала. Два крупных эластичных пояса соединяются с внутренней частью низа мешочка и наряду с направлением волосков указывают на то, что при спаривании мешочек целиком выворачивается наружу. Снаружи нижней части уретрального мешочка остистых волосков нет (Spotorno, 1979).
Большие черные глаза имеют вертикальный щелевидный зрачок (Walker 1968). Хрусталик большой и выпуклый.
Функционирование
Проводящий аппарат среднего уха домашних чилийских шиншилл связан с окружающей полостью поддерживающими связками и таким образом может свободно перемещаться. Единственная ось подвижного среднего уха чилийской шиншиллы проходит через центр тяжести. Когда косточки находятся в движении, не создается сила, которая могла бы заставить их сместиться с оси. Опорные или поддерживающие связки, поскольку они лежат на оси, минимизируют сопротивление. Большое усилие, возникающее при работе молоточка, также распределяется равномерно, уменьшая момент инерции и, вероятно, способствуя восприимчивости к высоким частотам (Vrettakos et al., 1988).
Показатель базального метаболизма у дикой длиннохвостой шиншиллы составляет (n=6) в среднем 0,66 мл О2 /gh, теплопроводность кожи – 0,0376 мл О2 /gh Co . Теплопроводность в He-O2 0,089 мл/ghC◦ Таким образом, чилийская шиншилла обладает наибольшей теплоизоляцией (Cortes et al., 2000).
Потеря воды при испарении у диких чилийских шиншилл (среднее ± СКО, n=6) составляет 0,58±0,1 мг H2O/gh при температуре окружающей среды ≤20oС. При температуре от 25 до 30oC потеря воды при испарении достигает 0,74±0,09 и 0,89±0,14 мг H2O/gh соответственно (Cortes et al., 2000).
Chinchilla laniger выделяет концентрированную мочу. У 10 домашних чилийских шиншилл, лишенных воды на срок до 8 дней, средняя осмомоляльность мочи составляла 3,505 мОсм / кг (диапазон, 2,345-7,599 мОсм / кг - Weisser et al., 1970). Чилийская шиншилла демонстрирует удлинённые почечные сосочки и высокий почечный индекс со схожей медуллярной толщиной. В условиях нехватки пищи и воды не наблюдалось снижения концентрации натрия в моче (Gutman and Beyth 1970).
Размер фекалий (в среднем 8,6 на 3,9 мм) варьируется в зависимости от размера животного, длиннее и уже они у самцов (Jime'nez 1990a). Болюсы темные, их едва ли можно разломать голыми руками. Свежие фекалии на ощупь сухие.
Ректальная температура тела составляет 35,88 °С у домашних самцов и 36,48 °С у самок (Kraft 1994). Температура тела колеблется от 38 до 39,8 °C. Пульс составляет 100-150 уд/мин, частота дыхательных движений 40-80 вдохов/мин (Webb 1991).
Параметры крови у домашних животных: эритроциты, 6,6-10,7 млн/мл; гемоглобин, 11,7-13,5 г/дл; средний гематокрит, 38%; лейкоциты, 7,6-11,5 х 103/мкл; моноциты, 1-4%; лимфоциты, 51-73%; нейтрофилы, 23-45%; эозинофилы, 0,5-2,6%; базофилы, 0-1%. Количество тромбоцитов составляет 254-298 х 103 мкл (Hillyer et al. 1997). Чилийские шиншиллы столь же чувствительны к бычьему инсулину, как и к своему собственному, а их антигенные детерминанты и активные центры являются промежуточными между инсулином быков и морских свинок (Neville et al., 1974).
Вспомогательные репродуктивные железы домашних самцов в течение года работают в зависимости от концентрации тестостерона в крови, которая становится наивысшей в период с апреля по август с заметным, но кратковременным снижением в июне (Orostegui et al., 1996). Масса и диаметр семенных пузырьков самца наибольшая в периоды аустральной осени и зимы (минимальная средняя масса ± СКО в феврале: 0,32±0,05 г; максимальная средняя масса ± СКО в мае: 1,4±0,5 г; минимальный средний диаметр ± СКО в январе: 1,488±352.2 мм; максимальный средний диаметр ± СКО в июне: 4,635.1±1,418.6 мм; n=48). Бульбоуретральные железы также меняются (минимальная средняя масса ± СКО в ноябре: 0,11±0,05 г; максимальная средняя масса ± СКО в мае: 0,4±0,06 г; минимальный средний диаметр ± СКО в феврале: 3,2±0,52 мм; максимальный средний диаметр ± СКО в июне: 6,3±0,19 мм: n=50. Cepeda et al 1999).
Объем эякулята составляет 0,1-0,5 мл и содержит 20-200 миллионов сперматозоидов. Сперма может преодолеть 25 мм за 4 мин (Asdell 1964).
Фолликулы у беременных домашних самок устойчивы к эндогенному гонадотропину, однако овуляция может возникнуть во время анэструса. Овуляция может быть вызвана, если спаривание происходит достаточно рано вследствие преждевременного всплеска лютеинезирующего гормона. Жёлтые тела во время беременности примерно вдвое больше, чем во время нерепродуктивной стадии цикла; они не уменьшаются, пока овуляция не повторится. Регресс жёлтого тела может быстро прекратиться или же продолжаться в течение нескольких циклов. Дополнительное желтое тело формируется во время беременности, но также это может происходить при бесплодном эструсе у некоторых самок. Наблюдаются обширные реминанты мезонефральной трубки и зародышевых овариальных тканей (Weir and Rowlands 1974). Беременность зависит от прогрессирующего увеличения прогестерона, продуцируемого только совокупностью яичников с жёлтым телом и интерстициальной ткани (Tam 1974).
Онтогенез и размножение
Семь (весом менее 100 г) молодых особей, были пойманы в дикой природе с октября по декабрь, что исключает второй помёт (J. E. Jimenez, персональные комментарии). Домашние C. laniger размножаются с мая по ноябрь в южном полушарии (Neira et al., 1989) и с ноября по май в северном полушарии (Weir 1973). Обычно за год происходит два приплода.
Домашние самки демонстрируют длинный цикл эструса (среднее ± СКО, 38,1±0,7 дней; n=323; диапазон, 16-69); эструс длится 48 часов. Послеродовой эструс обычно происходит спустя 57,4±2,6 дней независимо от того, потеряно потомство или нет. Вагинальная закрывающая мембрана при анэструсе может открыться и закрывается через 12 часов, но обычно это происходит в течение 2-4 дней; пока мембрана открыта, отмечается наличие лейкоцитов (Weir 1974). Открытая вульва, зачастую с видимой слизью, является внешним признаком эструса. Вульва во время эструса не набухает; скорее, происходит изменение цвета промежности от светло-розового до тёмно-красного. Окраска промежности резко усиливается при вагинальной перфорации и остается интенсивной на протяжении большей части лютеиновой фазы (Brookhyser and Aulerich 1980).
Овуляция в неволе обычно спонтанная, иногда происходит до открытия вагины. Копуляционная пробка обычно видна после спаривания. Одноклеточные зиготы были обнаружены в фаллопиевых трубах спустя 1-2 дня после спаривания. Оплодотворение трудно обнаружить, поскольку в некоторых яйцеклетках нет следов полярных телец, спермы или пронуклеусов, хотя в некоторых из них в течение 2,5 дней после спаривания наблюдается одно полярное тельце и сперма в zona pellucida, либо одно полярное тельце и второе веретено деления созревания (Roberts and Perry 1974). Полиспермия не наблюдалась. Преимплантированные бластоцисты были обнаружены спустя 3,5 дня после спаривания (Weir and Rowlands 1974).
Имплантация происходит через 5,5 дней после спаривания и полностью интерстициальна. Абэмбриональный полюс бластоцисты состоит из эктоплацентарного трофобласта, который окружает эктоплацентарную полость, часто заполненную экстравазированной материнской кровью. Децидуальная полость значительно увеличивается в размерах, особенно в антиметрической области, где она расширяется и приобретает форму гантели на 10 день после спаривания. Амниотическая полость формируется через 15, аллантоисная через 25, хорионаллантоисная плацента через 30 дней после спаривания. У самок весом от 400 до 700 граммов доношенная плацента имеет вес 9 граммов и диаметр 22 мм. Скорость роста плода у одомашненных чилийских шиншилл самая низкая среди гистрикоморфов. Удельная скорость развития плода у них составляет 0,043 (Roberts and Perry 1974).
Волосы 105-дневного плода одиночные и независимые. Смена шерсти на взрослую в неволе происходит до 2-месячного возраста. Эпидермис плода, новорожденного и 2-месячного животного напоминает взрослый, однако весьма заметен зернистый слой, при этом роговой слой несколько тоньше (Wilcox 1950).
Реабсорбция плода происходит часто и может случиться на любой стадии беременности. Даже на поздних стадиях, когда скелетная ткань плода сформирована, происходит реабсорбция, а не мумификация или спонтанный аборт. Ни плацента, ни эмбриональная ткань не могут быть распознаны в некротической массе, однако часто встречается центральная полость, заполненная кровью (Roberts and Perry 1974).
Продолжительность беременности в неволе составляет 111 дней (диапазон - 105-118 дней). Обычно роды происходят рано утром, плацента зачастую съедается (Hillyer et al., 1997). Размер помёта составляет от 1 до 6 детенышей, обычно 2 или 3 (в среднем 1,75; n = 273 помёта - Neira et al., 1989). Соотношение полов при рождении (самцы:самки) составляло 1,19 (Galton 1968) в колониях северного полушария и 1,10 в колониях Южного полушария; при окончании грудного вскармливания в последнем случае соотношение полов составило 1,24 (Vinas 1997).
Средняя неонатальная масса в неволе составляет 52 г (диапазон 50-70, n = 149 - Neira et al., 1989). Средняя масса новорожденного помета составляет 83,3 г (n = 211); индивидуальная масса обратно пропорциональна размеру помета. Среднее число живорождённых составляет 1,59 (n = 273), при смертности 10,4%. Иногда 1 новорожденный меньше, чем другие из того же помета. Все новорожденные рано сформированные, полностью покрытые шерстью, с прорезавшимися зубами, открытыми глазами и способны ходить спустя час после рождения. Они начинают потреблять твердую пищу в возрасте 1 недели (Hillyer et al., 1997). Скорость роста составляет 3,6 г/сут в течение 1-го месяца, снижается до 1,56 г/сут с 2 до 6 месяцев и до 0,65 г/сут в возрасте от 6 до 12 месяцев (Neira et al., 1989).
Обычно лактация в неволе длится 6-8 недель (среднее значение - 54 дня), минимальный период кормления детеныша материнским молоком, необходимый для выживания, составляет 25 дней. Средний размер помёта при отлучении от соска составляет 1,31 (n = 273), средняя масса помёта при отлучении составляет 342,9 г (n = 193). Смертность от рождения до момента отлучения составляет 21,3% (Neira et al. 1989).
Половая зрелость у обоих полов наступает в среднем через 8 месяцев, но может произойти уже через 5,5 месяцев (Weir 1974). В южном полушарии домашние самки, рожающие не впервые, вероятнее всего, беременеют летом и весной. Первый помёт самки приносили при среднем возрасте 459 дней, с интервалом между помётами - 214 дней; животные весили 605 г при спаривании, 742 г при родах и 648 г в послеродовой период (Neira et al., 1989).
Максимальная продолжительность жизни в дикой природе составляет 6 лет (Jimenez 1990a). Несколько шиншилл в неволе жили >20 лет, а некоторые из них были плодовиты в 15 лет. Средняя продолжительность жизни в зоопарках 4 года (максимум – 7 лет, Eisenberg 1981).
Экология
Естественной средой обитания чилийских шиншилл являются бесплодные, засушливые и суровые области поперечных горных цепей на севере центральной части Чили, которые соединяют прибрежные горные районы с Андами и имеют высоту от 400 до 1650 м. Часто происходят сходы потоков воды с гор. Русла рек большую часть года сухие, хотя в некоторых районах реки текут круглый год. Среднегодовое количество осадков с 1974 по 1998 год в данном регионе составляло 165,4 мм ± 122,6 СКО (Deane 1999). Максимальное количество осадков обычно выпадает в мае-августе во время аустральной зимы (Waylen and Caviedes, 1990). Длительный сухой сезон продолжается с октября по апрель. Количество осадков колеблется от 15,8 до 513,4 мм / год.
Типичная среда обитания - скалистая или песчаная, изредка покрытая колючим кустарником, некоторыми растениями и разнотравьем, отдельными кактусами и участками суккулентов семейства бромелиевых по направлению к побережью. Эти растительные сообщества представляют собой смесь видов, типичных для северной ксерической пустыни и мезических южных средиземноморских зон (Sarmiento, 1975). Чилийские шиншиллы находят убежище в щелях, углублениях посреди или под скалами или в крупных агавоподобных бромелиях (Puya berteroniana (пуйя Бертерони) - Jimenez 1990a).
Chinchilla laniger - общественное животное. Обычно колонии насчитывают около 100 особей (Albert 1900). Колонии площадью 1,5-113,5 га, располагаются обычно на склонах, обращенных к экватору (Jimenez 1995). В 1990 году две колонии насчитывали 450-500 особей (Jimenez 1990a). Изолированные колонии образуют метапопуляцию, для которой характерны частые локальные вымирания и колонизация подходящих мест обитания. Плотность популяций составляет 4,37 особей / га. Размер популяции не зависит от количества осадков в году (Jimenez et al., 1992). К хищникам относятся андские лисы или кульпео (Pseudalopex culpaeus), которые ловят как взрослых, так и детенышей шиншилл, а также магеллановы филины (Bubo magellanicus), которые охотятся в основном на молодых особей (Jimenez 1993).
Дикая чилийская шиншилла потребляет около 24 видов растений, главным образом травы и побеги злаков. Диета меняется как сезонно (Serra 1979), так и между годами. Летом они потребляют суккуленты (Cortes et al., 2002). Основным местным растением, выбранным в тестах «кафетерий» осенью и весной, было Nasella chilensis (Pizarro 1988), которое также является наиболее часто встречающимся элементом в фекалиях, собранных в дикой природе (Cortes et al., 2002). Stipa plumosa является вторым предпочитаемым C. laniger растением в это время года. Чилийские шиншиллы выбирают растения с большим количеством клетчатки и с меньшим содержанием лигнина (Pizarro, 1988). По-видимому, в дикой природе они не пьют воду.
Среди заболеваний диких шиншилл известна только болезнь Чагаса, вызываемая спирохетами трипаносома крузи (Trypanosoma cruzi). Переносчиком её является эндемичное полужесткокрылое насекомое Triatoma spinolai. В Ауко проценты заражения составляли 20% из 35 особей (Duran et al., 1989) и 40% из 20 животных (Jime'nez and Lorca 1990). В Ауко процент зараженных особей составил 20% из 35 животных (Duran et al., 1989) и 40% из 20 животных (Jimenez and Lorca 1990). С 1939 по 1987 год 29,4% из 53 животных были инфицированы трипаносомой (Apt and Reyes 1990).
Бактериальная флора диких особей разнообразна. Большинство видов, встречающихся в пищеварительном тракте (53 особи), респираторной системе (18 особей) и мужских половых органах (33 особи), являются такими же, как и у домашних шиншилл (Miller and Finegold 1967). Наиболее распространенными являются Listeria grayi, непатогенные бактерии (Mathieu 1980).
К мелким млекопитающим, которые сосуществуют с чилийскими шиншиллами в засушливых районах севера центральной части Чили, относятся сумчатые: изящный мышиный опоссум (Thylamys elegans), мышевидные грызуны: оливковый южноамериканский полевой хомячок (Akodon olivaceus), Akodon longipilis, листоухий хомячок Дарвина (Phyllotis darwini) и гристрикоморфные грызуны: шиншилловая крыса Беннетта (Abrocoma bennetti) и дегу (Octodon degus) (Osgood 1943).
Чилийскую шиншиллу нелегко поймать. Лучшая ловушка для поимки этих животных живыми сделана из проволочной сетки (Jimenez 1987) и смазана овсяными хлопьями (Jimenez 1989). Индейцы в доколумбовый период охотились на C. laniger из-за шерсти, мяса и шкурок (Molina 1782). В 19 веке цены на шкурки на международных рынках сильно выросли, и охотники того времени истребили шиншилл до почти полного исчезновения (Jimenez 1994).
C. laniger первоначально одомашнивались с целью получения меха, но теперь чилийские шиншиллы также выращиваются как чистоплотные, не имеющие запаха дружелюбные домашние питомцы (Webb 1991), а также как лабораторные животные. Они используются для изучения слуха и поведения; шиншиллы легко поддаются дрессировке, и у них развито среднее ухо (Vrettakos et al., 1988). Их среднее ухо и улитка (Robles and Ruggero 2001) легкодоступны для записывающих электродов. Они менее подвержены инфекционным заболеваниям уха, чем лабораторные крысы, и их слуховая кривая больше похожа на человеческую, чем у обычных видов лабораторных животных (Heffner and Heffner 1991).
Животноводство
Chinchilla laniger была одомашнена несколько раз, но большинство, если не все нынешние популяции в неволе, были получены от 12 диких чилийских шиншилл, пойманных в окрестностях Потрерильоса и доставленных в Калифорнию инженером из США Мэтью Чапменом в 1923 году (Parker 1975). Некоторые селекционеры называют этих домашних особей гибридами, но это вовсе не означает, что они являются настоящими межвидовыми гибридами.
Чилийские шиншиллы - территориальные и ловкие животные. Их необходимо содержать либо семьями, либо индивидуально на больших пространствах. Поскольку они являются ночными животными, клетки следует размещать в зоне без сквозняков, которая позволяет спать днём.
Особи должны содержаться в клетках объемом не менее 0,0251 м3 (ширина 0,35 м, 0,40-0,50 м в длину и 0,30 м в высоту). В системах размножения, используемых в меховой промышленности, 1 самец имеет доступ к нескольким самкам в ошейниках, содержащимся в отдельных клетках, минимальный размер клетки для племенных самок составляет 0,036 м3. Для небольших колоний клетки должны быть длиной не менее 1 м и 0,5 м в высоту и ширину, должны содержать полки, которые обеспечивают достаточную физическую нагрузку. Трубы диаметром 10-13 см, висящие в верхней части клетки, добавляют возможности для движения и места для укрытия (Hillyer et al., 1997). Передняя, задняя и верхняя части клеток должны быть сделаны из сетки, которая позволяет беспрепятственно циркулировать свежему воздуху; примерная циркуляция воздуха в больших колониях составляет 8 объемов / час зимой и 15 объемов / час летом (G. Lara, in litt).
Температура в помещении для проживания шиншилл должна быть в диапазоне между 17 и 25°C (Grau 1986). Чилийские шиншиллы склонны к получению теплового удара и никогда не должны подвергаться воздействию температуры выше 30°C (Hillyer et al. 1997). Длина и плотность волос возрастают при поддержании температуры 5-12°C (G. Lara, in litt.) и относительной влажности менее 50% (Webb 1991).
Промышленные гранулы являются идеальными продуктами для чилийских шиншилл, если есть возможность их приобрести; общепринятая формула - 10-20% белка, 2-5% жира и 15-35% клетчатки (Webb 1991). Ежедневно следует давать около 30 г гранул, а также горсть сушеного сена тимофеевки. Такой вариант более предпочтителен в Соединенных Штатах по сравнению с люцерной, которая содержит гораздо больше белка; последний вариант является более предпочтительным в Южной Америке. Сушеные яблоки, финики, зерна, фундук, изюм и семена подсолнечника должны быть ограничены не более чем 1 ложкой в день. Изменения в рационе должны быть постепенными, поскольку резкое изменение диеты может вызвать серьезные заболевания (Hillyer et al., 1997).
Индивидуальное потребление воды около 25-50 мл ежедневно. Ёмкости с водой следует подвешивать вне клетки, они должны быть жесткими, если же они сделаны из пластика, необходима защита для предотвращения проколов. Внутри клетки необходимо разместить металлическое колесо.
Поскольку резцы постоянно растут, необходим кусок дерева (не кедр) для погрызания, что способствует стачиванию зубов. Клиническим признаком малокклюзии является чрезмерное слюнотечение с мокрым мехом вокруг подбородка, груди и передних лап; корни щёчных зубов также начинают проникать наружу из орбит глаз, вызывая слезотечение (Webb, 1991).
Песчаные ванны для удаления влаги и жира из шерсти должны быть доступны ежедневно или, по крайней мере, несколько раз в неделю. Дезинфицированный песок для шиншилл доступен в продаже; песок с пляжа или с детской площадки не подходит. Песок помещается слоем толщиной 2–3 см в достаточно большую емкость, чтобы животное могло кататься; песок должен быть чистым и без фекалий (Hillyer et al. 1997). Домашним животным допустимо играть в ночное время в зоне, которая позволяет прыгать и бегать.
Хотя чилийские шиншиллы пугливы, приручить их несложно, особенно если приучать их к этому с раннего возраста. Их можно держать на плече, но, если хватать животное или грубо обращаться с ним, это приведет к локальному сбрасыванию шерсти. Также их можно удерживать за основание хвоста; тело при этом поддерживается другой рукой (Webb, 1991). Кусаются они редко, исключение составляют крайне неблагоприятные ситуации.
Хорошим индикатором здоровья животного является состояние его фекалий (Kluhner 1987). Фекалии твердые, темные длиной около 1 см. Дикие особи производят около 223 болюсов фекалий в день (Jime'nez 1990a); домашние животные производят в среднем 209 болюсов (n = 8 - G. Lara, in litt). Чилийские шиншиллы практикуют копрофагию или поедание фекалий; это помогает им поддерживать микрофлору пищеварительной системы. По этой причине пенициллин им нельзя вводить перорально.
Основными причинами отбраковки в домашних популяциях являются бесплодие (44%), возраст (24%), болезни (20%) и драки (12% - Neira et al. 1989). Для 2 племенных колоний в Чили общий уровень рождаемости составил 69 на 100 шиншилл, а общий коэффициент рождаемости составил 3.06 новорожденных для каждого самца и 1,73 для каждой самки. Индивидуальная плодовитость в зависимости от возраста наиболее высока в возрасте от 1 до 6 лет у самок и от 1 до 6,5 у самцов; далее плодовитость постепенно уменьшается. В течение репродуктивного периода среднее количество 20,8 новорожденных у самок, у самцов - 51,1 (Vinas 1997).
Доступны сведения о лечении и патологиях (Bickel 1987), а также о ветеринарной практике (Hillyer et al., 1997, Webb 1991). Руководство по адекватному и гуманному разведению чилийских шиншилл, в том числе специальную анкету для определения качества, можно получить в Совете Chinchilla Industry (1992), организации, в которую входят представители меховой промышленности.
Поведение
Чилийские шиншиллы тихие, пугливые, но активные животные. Отталкиваясь своими длинными задними лапами, с поразительной ловкостью они передвигаются по скалам в своей обычной среде обитания. Животные эти, как правило, филопатрические, проживают на небольшом участке в течение целых 6 лет. Они используют крупные камни для отдыха и наблюдения за территорией. Чилийские шиншиллы мочатся и испражняются на камни, формируя туалеты, которые обозначают их присутствие (Jimenez, 1990b). Домашние животные испражняются между 03:00 и 06:00 и потребляют цекотрофы между 08:00 и 14:00 (Holtenius and Bjornhag 1985). Во время еды чилийские шиншиллы сидят прямо и держат пищу в передних лапах.
Молодые особи часто лежат на спине во время сосания (Weir 1970). Отцы проявляют терпимость и довольно дружелюбны, сидят с матерью и молодняком, оберегая их (Kleiman 1974). Матери обычно кормят потомство небольшими порциями пищи (Альберт, 1900). Молодые особи проявляют игровое поведение в стиле «прыг-скок», которое включает в себя вертикальные прыжки, скручивание тела, покачивание головы, гонки с поворотами, а также прыжки с отталкиванием задними лапами (Kleiman 1974).
От стресса шиншиллы в неволе сбрасывают шерсть. Самки очень агрессивно относятся друг к другу и к самцам, даже в периоде эструса. Угрозы проявляются с помощью рычащих криков, скрежета зубов или мочеиспусканием (только в неволе, о таком поведении не сообщается в дикой природе). Самки менее агрессивны при послеродовом эструсе, чем в иное время (Healey and Weir 1970). Ритуалы ухаживания включают взаимный груминг и подход самца на задних лапах (Kleiman 1974). Копуляционный тип представляет собой множественные интромиссии (в среднем 5) по 5 с каждая, и многократных эякуляций (диапазон 1 или 2) с эякуляторными интромиссиями продолжительностью 8-10 с каждая. Во время интромиссии происходит толчок. Самки остаются восприимчивыми в течение нескольких часов (Bignami and Beach 1968).
Особи издают различные звуки. При испуге или поимке раздается «иик-иик». Изолированные самцы могут издавать звук «ньяк-ньяк» (Eisenberg 1974).
Небольшие убежища чилийские шиншиллы сооружают под и между камнями. Под входом проходит прямой коридор, далее он поворачивает, открываясь в более широкое помещение, которое служит общей спальней, и, вероятно, гнездом, если выстелить его высушенным сеном или мягкими материалами. Там могут храниться вяжущие оболочки и сладкие семена альгаробиллы (Balsamocarpon brevifolium) (Albert 1900). Иногда в убежищах также хранятся водянистые плоды кактусов (Opazo 1911).
Чилийские шиншиллы очищают свой нежный мех песком или купанием в грунте (Stern and Merari 1969). В дикой природе они многократно купаются в одном и том же месте, оставляя при этом утрамбованный круг мелкой пыли около 40 см в диаметре вблизи входа в нору.
Генетика
Все хромосомы чилийской шиншиллы двуплечие с 2n = 64 (Hsu и Benirschke 1967) и FN = 128 (Makino 1953; Nes 1963). Метацентрическая Х-хромосома является наибольшей в хромосомном наборе у 9% гаплоидного набора аутосом (Galton et al., 1965); она имеет удвоенный тип (Ohno et al., 1964) с большим участком поздней репликации на коротком плече (Galton et al., 1965), что соответствует большой C-полосе по положению и размеру. В дополнение к удвоенной Х-хромосоме существует очень маленькая Y-хромосома, которая была ошибочно идентифицирована как большая хромосома (Makino 1953). Ассоциация хромосом X и Y в мейозе всегда сквозная, что означает отсутствие полного синапсиса. XX биваленты у самок имеют 4 хиазмы (Galton et al., 1965). Нуклеолярная организованная область находится на втором сужении длинного плеча одиночной субметацентрической пары хромосом (George and Weir 1974). Одиночные ядра встречаются в субцентральном ядерном пространстве сперматоцитов (Berrıos et al., 2004).
Последовательности гена цитохрома-b из митохондриальной ДНК дикой и домашней C. laniger разделяют 3 характерных участка, не присутствующих у других видов шиншилл: основание C на участке 11 (второе положение кодона), G на участке 93 и T на участке 150. Два вида шиншилл имеют различия в 22 участках, из которых три являются первым или вторым положениями кодона, с двухпараметрической генетической дистанцией Кимуры около 6% (Spotorno et al. 2004; Valladares 2002). Все дикие C. laniger имеют характерное основание A на участке 366 (Spotorno et al., 2004). Дикие образцы из Ауко имеют 4 характерных основания на участках 47, 198, 234 и 495. Один экземпляр из Ла-Игуэра имел 5 аутоапоморфных мутаций на участках 147, 264, 265, 266 и 429. 5 домашних C. laniger имели 2 характерных нуклеотида: основание T на участке 33 и A на участке 85 (второе положение кодона) и имеют однаковое с одним диким образцом из Ла-Игуэра (Кокимбо) уникальное скрытое G-основание на участке 63, что согласуется с обозначенным в документах историческим происхождением нынешних одомашненных C. laniger (Parker 1975). Никаких следов вариаций C. brevicaudata, диких или домашних, не было найдено ни у одной из 5 домашних C. laniger (Spotorno et al., 2004). Микросателлитные маркеры ДНК были амплифицированы из фекалий (Walker et al., 2000). У домашних популяций было описано множество мутаций, дающих различную окраску шерсти (Grau 1986).
Гибриды, полученные в результате скрещивания с C. brevicaudata, являются промежуточными по длительности беременности. Гибридные самцы бесплодны. Гибридные самки плодовиты, но при обратном скрещивании около 2/3 гибридов второго поколения стерильны (Grau 1986).
Охранный статус
Чилийская шиншилла находится под угрозой исчезновения (Glade 1988, Thornback and Jenkins, 1982) и имеет второй приоритет охраны среди чилийских млекопитающих (Cofré and Marquet 1999). Дикие популяции указаны в Приложении 1 к СИТЕС (CITES 1991). В результате чрезмерной охоты ради добычи меха (Iriarte and Jaksic 1986) в начале 1900-х годов этот вид был почти полностью истреблён (Jimenez, 1994). Несмотря на защиту, предусмотренную соглашением, подписанным правительствами Аргентины, Боливии, Чили и Перу (Grau 1986), а также согласно закону Чили от 1929 года (Lagos and Valverde 1998), браконьерство продолжалось. К 1950-м годам чилийская шиншилла считалась вымершей (Mann 1978). Дикие популяции были повторно открыты в 1978 году, а в 1983 году был создан национальный заповедник Chinchillas (Lagos and Valverde 1998). Площадь заповедника составляет 4227 га, из которых на 556 га до 1983 года наблюдались колонии шиншилл, но в 1989 году площадь, занимаемая колониями, составила 264 га (Jimenez 1990b). Былые ареалы распространения сократились главным образом до двух областей. Лишь 19 из 42 известных колоний находятся под охраной в национальном заповеднике Las Chinchillas в настоящее время (Jimenez 1996). Общая численность дикой популяции оценивается в 2500-11700 особей и имеет тенденцию к снижению, о чем свидетельствует сокращение площади, занимаемой нынешними колониями, и их фрагментация (Jimenez, 1993). Несмотря на то, что с 1987 года шиншиллы в заповеднике защищены от деятельности человека, численность популяции продолжает снижаться (Jimenez 1996). С 1990 года действует план по защите (Lagos and Valverde 1998), но никаких особых мер по охране северной популяции в Ла-Игуэра, имеющей малое генетическое разнообразие, не принимается.
Замечания
Молина (1782: 301) описал «La Chinchilla, Mus laniger (I. Mus cauda mediocri, palmis tetradactylis, plantis pentadactilis, corpore cinereus lanato.)» так: «Это ещё один из видов полевых мышей. Особую ценность представляет их тонкая шерсть, которой они покрыты вместо волос. Она чрезвычайно мягкая, подобно шёлку, который производят садовые пауки, и имеет серо-серебристый цвет, также она достаточно длинная, чтобы её можно было прясть''. Беннетт (1829) предложил новое родовое название «Chinchilla» для «Mus laniger», описанного Молиной; а также заменил Laniger женским Lanigera, полагая, что Laniger - прилагательное. Более поздние авторы следовали такому написанию (Woods 1993), не подозревая, что laniger вполне можно использовать как существительное-дополнение; некоторые сохранили оригинальное написание (например, Gray 1830). Прелл (1934) формально отверг описание, данное Молиной, как неоднозначное, не подлежащее идентификации и даже применимое к животным рода Abrocoma, не описанным во времена Молины. Однако Молина (1782) описал хвост, покрытый мягким мехом («vestita di morbido pelo»), в отличие от хвоста Abrocoma, волосы на котором очень короткие, длиной 1 мм, из-за чего он выглядит голым. Кроме того, Молина (1782) обозначил цвет шерсти как ''cenerino ''. Так обычно называют блестящий серый, который выглядит почти как холодное серебро, в отличие от цвета Abrocoma bennetti, обитающих в центральной части Чили, цвет шерсти которых пепельно-серый, смешанный с теплым коричневым (Spotorno et al., 1998). Молина (1782) отметил, что Mus laniger не имеет неприятного запаха, тогда как у диких Abrocoma имеется сильный органический запах растительного масла. Прелл отклонил наименование laniger и предложил взамен новое специальное обозначение velligera, этот же термин принял Осгуд (1941) сначала условно, а затем и формально (Osgood 1943). Точка зрения Прелла была проанализирована и признана не имеющей серьезной научной основы (Cabrera 1960). Международной комиссии по зоологической номенклатуре было предложено включить C. laniger в официальный список научных наименований (Valladares and Spotorno 2003).
Общеупотребительное слово шиншилла, может происходить из слова «чин» языка кечуа, означающего «тихий», «синчи» также может означать сильный или мужественный (Grau, 1986), окончание –лла - уменьшительно-ласкательное в языке кечуа. В совокупности «Chinchilla» могла бы означать «сильный, тихий малыш» (Aleandri 1998). Слово laniger происходит от латинского и переводится как «шерсть». Общеупотребительное название чилийской шиншиллы использовалось Осгудом в 1941 году, а также в 1-й современной редакции описания чилийских млекопитающих (Osgood 1943) для этого эндемического и, скорее всего, автохтонного вида Чили. Кабрера (1960: 195) писал: «Durante siglo y medio, Mus laniger Molina, 1782, fue universalmente identifacado como la chinchilla chilena (o '' costina '', si se pre fi ere el cali fi cativo takeado en peleterı'a)…). [В течение полутора веков Mus laniger Molina, 1782, универсально обозначался как чилийская шиншилла (или «береговая», если имеется в виду обозначение, принятое в меховой индустрии).] Иные обозначения данного вида: chinchilla (шиншилла), chinchilla chilena (чилийская шиншилла), coastal chinchilla (береговая шиншилла), chinchilla costina, chinchilla velligera, chinchilla cola larga, long-tailed chinchilla (длиннохвостая шиншилла), chinchilla chica, and small chinchilla (малая шиншилла).
Наша работа была выполнена при поддержке гранта Fondo Nacional de Ciencia y Tecnología (FONDECYT 198 1122, Chile to A. E. Spotorno). Секторный проект FONDECYT (596 0017 to A. E. Spotorno) позволил начать полевые и лабораторные работы. Мы благодарим Servicio Agrıcola y Ganadero и Национальный лесной фонд Министерства сельского хозяйства Чили (collection permits 2273, August 1997; 1454, May 1999; and 3042, October 1999), в частности Агустина Ириарте, за выдачу разрешений на сбор образцов; Также мы благодарим Гонсало Лара (бывший президент Instituto de la Chinchilla A.G., Чили) за добровольное пожертвование экземпляров домашних шиншилл, некоторые книги, обсуждение и пересмотр раздела «Животноводство»; Анхеля С. Споторно Л. за фото для рисунка 3; Хуана Оярсе за техническую помощь в сборе образцов и уходе за животными; А. Гарднера за помощь в синонимии; и 2 анонимных рецензентов.
Использованные источники литературы
ADARO, L., C. OROSTEGUI, R. CEPEDA, R. OLIVARES, AND M. SOTO. 1998. Troncos arteriales del aparato reproductor de la chinchilla (Chinchilla laniger Gray), en cautiverio. Revista Chilena de Anatomía 16:225–228.
ADARO, L., C. OROSTEGUI, R. OLIVARES, AND S. VILLANUEVA. 1999. Variaciones morfométricas anuales del sistema reproductor masculino de la chinchilla en cautiverio (Chinchilla laniger Grey [sic]). Avances en Producción Animal 24:91–95.
ALBERT, F. 1900. La chinchilla. Anales de la Universidad de Chile 107:915–934.
ALEANDRI, F. 1998. Cría y comercialización de la chinchilla. El Dorado, Buenos Aires, Argentina.
ANDERSON, S. 1997. Mammals of Bolivia, taxonomy and distribution. Bulletin of the American Museum of Natural History 231:1–652.
APT, W., AND H. REYES. 1990. Algunos aspectos de la enfermedad de Chagas en Latinoamérica. Parasitologia al Día 14:23–40.
ASDELL, S. A. 1964. Patterns of mammalian reproduction. Second edition. Cornell University Press, Ithaca, New York.
BENNETT, E. T. 1829. The chinchilla. Gardens and Menagerie of the Zoological Society of London 1:1–12.
BENNETT, E. T. 1835. On the Chinchillidae, a family of herbivorous Rodentia, and on a new genus referrible [sic] to it. Transactions of the Zoological Society of London 1:35–64.
BERRÍOS, S., R. FERNÁNDEZ-DONOSO, J. PINCHEIRA, J. PAGE, AND M. C. CERDA. 2004. Number and nuclear localisation of nucleoli in mammalian spermatocytes. Genetica 155:1–10.
BICKEL, E. 1987. Chinchilla handbook. Sixth edition. T. F. H. Publications, Neptune City, New Jersey.
BIGNAMI, G., AND F. A. BEACH. 1968. Mating behaviour in the chinchilla. Animal Behaviour 16:45–53.
BROOKES, J. 1828. A new genus of the order Rodentia. Transactions of the Linnean Society 16:96–105 (not seen, cited in Cabrera 1961).
BROOKHYSER, K. M., AND R. J. AULERICH. 1980. Comsumption of food, body weight, perineal color and level of progesterone in the serum of cyclic female chinchillas. Journal of Endocrinology 87:213–219.
BUGGE, J. 1984. Systematic value of the carotid arterial pattern in rodents. Pp. 355–380 in Evolutionary relationships among rodents: a multidisciplinary analysis (W. P. Luckett and J. L. Hartenberger, eds.). Plenum Press, New York.
CABRERA, A. 1960. Acerca de las chinchillas. Actas y Trabajos del Primer Congreso Sudamericano de Zoología, Universidad Nacional de La Plata, Argentina 4:195–202.
CABRERA, A. 1961. Catálogo de los mamíferos de América del Sur. II. Revista del Museo Argentino de Ciencias Naturales Bernardino Rivadavia, Ciencias Zoológicas 4:309–732.
CEPEDA, R., L. ADARO, P. PEÑAILILLO, AND C. OROSTEGUI. 1999. Variaciones morfológicas estacionales de las glandulas bulbouretrales de la chinchilla (Chinchilla laniger, Grey [sic]) en cautiverio. Revista Chilena de Anatomía 17:59–66.
COFRÉ , H., AND P. A. MARQUET. 1999. Conservation status, rarity, and geographic priorities for conservation of Chilean mammals: an assessment. Biological Conservation 88:53–68.
[CITES] CONVENTION ON INTERNATIONAL TRADE IN ENDANGERED SPECIES. 1991. Appendices I, II, III to the Convention on International Trade in Endangered Species of wild fauna and flora. September 1, 1991. U.S. Government Printing Office, Washington, D.C. 19 pp.
CORBET, G. B., AND J. E. HILL. 1980. A world list of mammalian species. British Museum (Natural History), London, United Kingdom.
CORTÉS, A., E. MIRANDA, AND J. JIMÉNEZ. 2002. Seasonal food habits of the endangered long-tailed chinchilla (Chinchilla lanigera): the effect of precipitation. Mammalian Biology 67: 167–175.
CORTÉS, A., M. ROSENMANN, AND F. BOZINOVIC. 2000. Relación costo beneficio en la termoregulación en Chinchilla lanigera. Revista Chilena de Historia Natural 73:351–357.
COUNCIL OF THE CHINCHILLA INDUSTRY. 1992. Reglas y normas de la operación humanitaria de los criaderos de chinchillas. Instituto de la Chinchilla AG, Santiago, Chile.
CUVIER, F. 1830. Histoire Naturelle des Mammifères, avec des figures originales, coloriées, dessinées d’apres des animaux vivans (E. Geoffroy St.-Hilaire and F. Cuvier, eds.). Paris, Museum d’Histoire Naturelle. 2:21–40 (not seen, cited in Anderson 1997).
DEANE, A. L. 1999. Statistical analysis of biologically important rainfall events in north central Chile. Master thesis, University of Florida, Gainesville, 100 pp.
DESMAREST, A. G. 1822. Mammalogie ou description des espéces de Mammifères. Paris, France. (not seen. Cited by Prell 1934).
DÍAZ, G. B., AND A. CORTÉS. 2003. Pequeños mamíferos en ambientes desérticos: los problemas de conservación de agua. Pp. 357–376 in Fisiología ecológica y evolutiva. Teoría y casos de estudios en animales (F. Bozinovic, ed.). Ediciones Universidad Católica de Chile, Santiago.
D’ORBIGNY, D., AND I. GEOFFROY SAINT-HILAIRE. 1830. Notice sur la Viscache et le Chinchilla, considérés comme les types d’un genre particulier, nommé Callomys, et Description d’une espèce nouvelle. Annales des Sciences Naturelles 21:282–297.
DURAN, J. C., M. I. VIDELA, AND W. APT. 1989. Enfermedad de Chagas en una comunidad de pequeños mamíferos simpátricos de la Reserva Nacional de las Chinchillas. Parasitologia al Día 13:15–20.
EISENBERG, J. 1981. The mammalian radiations. University of Chicago Press, Illinois.
EISENBERG, J. F. 1974. The function and motivational basis of hystricomorph vocalizations. Symposia of the Zoological Society of London 34:211–247.
FISCHER, G. 1814. Zoognosia tabulis synoptocis illustrata. In usum praelectionum Academiae Imperialis Medico-Chirurgicae Mosquensis. Volume 3. Typis Nicolai Sergeidis Vsevolozsky, Moscow, Russia.
GALTON, M. 1968. Chinchilla sex ratio. Journal of Reproduction and Fertility 16:211–216.
GALTON, M., K. BERNIRSCHKE, AND S. OHNO. 1965. Sex chromosomes of the Chinchilla: allocycly and duplication sequence in somatic cells and behavior in meiosis. Chromosoma (Berlin) 16:668–680.
GAY, C. 1947. Historia física y politica de Chile. Maulde & Renou, Paris.
GEOFFROY ST.-HILAIRE, È . 1803. Catalogue des mammifères du Muséum National d’Histoire Naturelle. [Muséum National d’Histoire Naturelle], Paris, France (page proof, not seen, cited in Anderson 1997).
GEORGE, W., AND B. WEIR. 1974. Hystricomorph chromosomes. Symposia of the Zoological Society of London 34:79–108.
GLADE, A. 1988. Libro rojo de los vertebrados terrestres chilenos. Corporación Nacional Forestal, Ministerio de Agricultura, Santiago, Chile.
GRAU, J. 1986. La chinchilla, su crianza en todos los climas. Third edition. Editorial El Ateneo, Buenos Aires, Argentina.
GRAY, J. E. 1830. Spicilegia zoologica; or original figures and short systematic descriptions of new and unfigured animals. Part I. Treuttel, Wurtz and Company, London, United Kingdom.
GUTMAN, Y., AND Y. BEYTH. 1970. Chinchilla laniger: discrepancy between concentrating ability and kidney structure. Life Sciences 9:37–42.
HANAMURE, Y., AND D. J. LIM. 1987. Anatomy of the chinchilla bulla and eustachian tube: I. Gross and microscopic study. American Journal of Otolaryngology 8:127–143.
HEALEY, P., AND B. J. WEIR. 1970. Changes in the ultrastrucuture of chinchilla spermatozoa in different diluents. Journal of Reproduction and Fertility 21:191–193.
HEFFNER, R. S., AND H. E. HEFFNER. 1991. Behavioral hearing range of the chinchilla. Hearing Research 52:13–16.
HILLYER, E. V., K. E. QUESENBERRY, AND T. M. DONNELLY. 1997. Biology, husbandry, and clinical techniques. Pp. 243–287 in Ferrets, rabbits, and rodents (E. V. Hillyer and K. E. Quesenberry, eds.). W. B. Saunders Company, Philadelphia, Pennsylvania.
HOLTENIUS, K., AND G. BJORNHAG. 1985. The colonic separation mechanism in the guinea-pig (Cavia porcellus) and the chinchilla (Chinchilla laniger). Comparative Biochemistry and Physiology, A. Comparative Physiology 82:537–542.
HSU, T. C., AND K. BENIRSCHKE. 1967. An atlas of mammalian chromosomes. Pp. 1–2 in Chinchilla lanigera (chinchilla). Springer Verlag, New York.
IRIARTE, J. A., AND F. M. JAKSIC. 1986. The fur trade in Chile: an overview of seventy-five years of export data (1910–1984). Biological Conservation 38:243–253.
JIMÉNEZ, J. E. 1987. Eficiencia relativa de seis modelos de trampa para la captura viva de micromamíferos silvestres, con énfasis en Chinchilla lanigera (Molina, 1782). Medio Ambiente (Chile) 8:104–112.
JIMÉNEZ, J. E. 1989. Uso de la técnica de tarjetas ahumadas para evaluar la efectividad de cebos para micromamíferos silvestres, con énfasis en Chinchilla lanigera. Medio Ambiente (Chile) 10:84–91.
JIMÉNEZ, J. E. 1990a. Bases biológicas para la conservación y manejo de la chinchilla chilena silvestre: proyecto conservación de la chinchilla chilena (Chinchilla lanigera). Final report. Corporación Nacional Forestal–World Wildlife Fund, Santiago, Chile.
JIMÉNEZ, J. E. 1990b. Proyecto conservación de la chinchilla chilena (Chinchilla lanigera). Final report. Corporación Nacional Forestal, Ministerio de Agricultura, Santiago, Chile.
JIMÉNEZ, J. E. 1993. Comparative ecology of Dusicyon foxes at the Chinchilla National Reserve in northcentral Chile. M.S. thesis, University of Florida, Gainesville, 100 pp.
JIMÉNEZ, J. E. 1994. Overuse and endangerment of wildlife: the case of Chilean mammals. Medio Ambiente (Chile) 12:102–110.
JIMÉNEZ, J. E. 1995. Conservation of the last wild chinchilla (Chinchilla lanigera) archipelago: a metapopulation approach. Vida Silvestre Neotropical 4:89–97.
JIMÉNEZ, J. E. 1996. The extirpation and current status of wild chinchillas (Chinchilla lanigera and C. brevicaudata). Biological Conservation 77:1–6.
JIMÉNEZ, J. E., P. FEINSINGER, AND F. M. JAKSIĆ . 1992. Spatiotemporal patterns of an irruption and decline of small mammals in northcentral Chile. Journal of Mammalogy 73:356–364.
JIMÉNEZ, J. E., AND M. LORCA. 1990. Trypanosomiasis Americana en vertebrados silvestres y su relación con el vector Triatoma spinolai. Archivos de Medicina Veterinaria (Chile) 22:171–183.
KAUP, J. 1832. Berichtigung, bie Gattung Callomys d’Orb. betressend. Isis 25(11): columns 1208–1211 (not seen, cited in Prell 1934).
KLEIMAN, D. G. 1974. Patterns of behaviour in hystricomorph rodents. Symposia of the Zoological Society of London 34:171–209.
KLUHNER, H. 1987. A step by step book about chinchillas. T. F. H. Publications, Neptune City, New Jersey.
KRAFT, H. 1994. Krankheiten der Chinchillas. Ferdinand Enke Verlag, Stuttgart, Germany.
LAGOS, V. O., AND V. VALVERDE. 1998. Conservación de la chinchilla chilena (Chinchilla lanigera). Avances y proyecciones del trabajo de manejo de esta especie. Pp. 73–82 in La conservación de la fauna nativa de Chile. Logros y perspectivas (V. Valverde, ed.). Corporación Nacional Forestal, Ministeriode Agricultura, Santiago, Chile.
LAWLOR, T. E. 1979. Handbook to the orders and families of living mammals. Second edition. Mad River Press, Eureka, California.
LESKE, N. G. 1779. Anfansgrunde der Naturgeschichte. S. L. Crusius, Leipzig, Germany 1:1–XX (not seen, cited in Musser and Carleton 1993).
LICHTENSTEIN, M. H. C. 1830. Eriomys chinchilla Licht. Die Chinchilla–Wollmaus. In Darstellung neuer oder wenig bekannter Säugethiere in Abbildungen und Bescreibungen von fünf und sechzig Arten auf funfzig colorirten Steindrucktaffeln nach den originalen des Zoologischen Museums der Universität zu Berlin. Königlichen Akademie der Wissenschaften. Heft 5, plate 28, plus 2 unnumbered pages of text. Königlichen Akademie der Wissenschaften, Berlin, Germany.
LINK, H. F. 1795. Ueber die Lebenskräfte in naturhistorisher Rücksicht und die Classification der Säugethiere. Beitraege zur Naturgeschichte, band 1, part 2. Karl Christoph Gtiller, Rostock, Germany.
LINNAEUS, C. 1758. Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Editio decima, reformata. Laurenti Salvii, Stockolm, Sweden 1:1–824.
MAKINO, S. 1953. Notes on the chromosomes of the porcupine and the chinchilla. Experientia 9:213–214.
MANN, G. 1978. Los pequeños mamíferos de Chile. Gayana, Zoología 40:1–342.
MATHIEU, X. 1980. Estudio de flora bacteriana normal de Chinchilla lanigera silvestre. Thesis Licenciado en Ciencias Pecuarias y Médico Veterinarias, Universidad de Chile, Santiago, 36 pp.
MILLER, L. G., AND S. M. FINEGOLD. 1967. Normal bacteria flora of the chinchilla. Bacteriological Proceedings 67:66.
MOLINA, G. I. 1782. Saggio sulla storia naturale del Chili. Stamperia di S. Tommaso dAquino, Bologna, Italy.
MUÑOZ-PEDREROS, A. 2000. Orden Rodentia. Pp. 73–126 in Mamíferos de Chile (A. Muñoz-Pedreros and J. Yañez, eds.). Ediciones Centro de Estudios Ambientales, Valdivia, Chile.
MUSSER, G. G., AND M. D. CARLETON. 1993. Family Muridae. Pp. 501–755 in Mammal species of the world: a taxonomic and geographic reference (D. E. Wilson and D. M. Reeder, eds.). Second edition. Smithsonian Institution Press, Washington,
D.C. NEIRA, R., X. GARCíA, AND R. SCHEU. 1989. Análisis descriptive del comportamiento reproductivo y de crecimiento de chinchillas (Chinchilla laniger Gray) en confinamiento. Avances en Producción Animal (Chile) 14:109–119.
NES, N. 1963. The chromosomes of Chinchilla laniger. Acta Veterinaria Scandinavica 4:128–135.
NEVILLE, W. J., B. J. WEIR, AND N. R. LAZARUS. 1974. Hystricomorph insulins. Symposia of the Zoological Society of London 34:417–435.
OHNO, S., W. BECAK, AND M. L. BECAK. 1964. X-autosome ratio and the behaviour pattern of individual X-chromosomes in placental mammals. Chromosoma (Berlin) 15:14–30.
OIKAWA, T., K. SHIMAMURA, T. R. SAITO, AND K. TANIGUCHI. 1994. Fine structure of the vomeronasal organ in the chinchilla (Chinchilla laniger). Jikken Dobutsu 43:487–497.
OPAZO, A. 1911. La chinchilla. Anales Agronómicos (Chile) 4:331–339.
OROSTEGUI, C., R. CEPEDA, B. URQUIETA, AND V. H. PARRAGUEZ. 1996. Ciclo reproductivo de la Chinchilla lanigera macho, en cautiverio. Revista Chilena de Anatomia 14:225–230.
OSGOOD, W. H. 1941. The technical name of the chinchilla. Journal of Mammalogy 22:407–411.
OSGOOD, W. H. 1943. The mammals of Chile. Field Museum of Natural History, Zoology Series 30:1–268.
PARKER, W. D. 1975. Modern chinchilla farming. Borden Publishing Co., Alhambra, California.
PIZARRO, H. 1988. Estudio preliminar alimentario y nutricional de las especies vegetales consumidas por Chinchilla lanigera y roedores simpátricos. Thesis Licenciado en Ciencias Pecuarias y Médico Veterinarias, Universidad de Chile, Santiago, 89 pp.
PRELL, H. 1934. Die gegenwartig bekannten Arten der Gattung Chinchilla Bennett. Zoologischer Anzeiger 108:97–104.
REDFORD, K. H., AND J. EISENBERG. 1992. Mammals of the Neotropics. The southern cone: Chile, Argentina, Uruguay, Paraguay. University of Chicago Press, Illinois.
ROBERTS, C., AND J. S. PERRY. 1974. Hystricomorph embryology. Symposia of the Zoological Society of London 34:333–360.
ROBLES, L., AND M. A. RUGGERO. 2001. Mechanics of the mammalian cochlea. Physiological Reviews 81:1305–1352.
SARMIENTO, G. 1975. The dry plant formations of South America: their floristic connections. Journal of Biogeography 2:233–251.
SCHAEFFER, D. O., AND T. M. DONNELLY. 1997. Disease problems of guinea pigs and chinchillas. Pp. 260–281 in Ferrets, rabbits, and rodents (E. V. Hillyer and K. E. Quesenberry, eds.). W. B. Saunders Company, Philadelphia, Pennsylvania.
SEELE, E. 1968. Haut und haart der Chinchillidae. Zoologischer Anzeiger (Leipzig) 181:60–75.
SERRA, M. T. 1979. Composición botánica y variación estacional de la alimentación de Chinchilla lanigera en condiciones naturales. Ciencias Forestales (Chile) 1:11–18.
SPOTORNO, A. E. 1979. Contrastación de la macro-sistemática de roedores caviomorfos por análisis comparativo de la morfología reproductiva masculina. Archivos de Biología y Medicina Experimentales 12:97–106.
SPOTORNO, A. E., J. P. VALLADARES, J. C. MARIN, R. E. PALMA, AND C. ZULETA. 2004. Molecular divergence and phylogenetic relationships among chinchillids (Rodentia, Chinchillidae). Journal of Mammalogy 85:384–388.
SPOTORNO, A. E., et al. 1998. Sistemática y adaptación de mamíferos, aves e insectos fitófagos de la Región de Antofagasta, Chile. Revista Chilena de Historia Natural 71:501–526.
STERN, J. J., AND A. MERARI. 1969. The bathing behavior of the chinchilla: effects of deprivation. Phychonomic Science 14: 115–116.
TAM, W. H. 1974. The synthesis of progesterone in some hystricomorph rodents. Symposia of the Zoological Society of London 34:363–384.
TEMMINCK, C. J. 1827. Monographies de Mammalogie, ou description de quelques generes de mammifères, dont les espèces ont été observées dans les différens musées de l’Europe. C. C. Vander Hoek, Leiden, The Netherlands 1:245–268.
THORNBACK, J., AND M. JENKINS. 1982. The IUCN mammal red data book. Part 1: threatened mammalian taxa of the Americas and the Australasian zoogeographic region (excluding Cetacea). International Union for the Conservation of Nature, Gland, Switzerland.
TIEDEMANN, D. F. 1808. Zoologie. Zu seinen Vorlesungen entworfen. Allgemeine Zoologie, Mensch und Säugthier. Webershen Buchhandlung, Landshut and Heidelberg, Germany. 1: xvi 1 1–610 1 2 unnumbered.
VALLADARES, J. P. 2002. Divergencia molecular de las especies silvestres y cepas domesticadas del género Chinchilla (Rodentia, Chinchillidae) basada en el gen para citocromo b. Mastozoología Neotropical 9:96–98.
VALLADARES, J. P., AND A. E. SPOTORNO. 2003. Case 3278: Mus laniger Molina, 1782 and Eriomys chinchilla Lichtenstein, 1830 (currently Chinchilla lanigera and C. chinchilla; Mammalia, Rodentia): proposed conservation of the specific names. Bulletin of Zoological Nomenclature 60, Part 3.
VIÑAS, S. J. 1997. Indicadores demográficos de fecundidad en poblaciones de chinchillas de criadero. Thesis Médico Veterinario, Universidad de Chile, Santiago, 46 pp.
VON KOENIGSWALD, W. 1985. Evolutionary trends in the enamel of rodent incisors. Pp. 403–422 in Evolutionary relationships among rodents. A multidisciplinary analysis (W. P. Luckett and J.-L. Hartenberger, eds.). Plenum Press, New York.
VRETTAKOS, P. N., S. P. DEAR, AND J. C. SAUNDERS. 1988. Middle ear structure in the chinchilla: a quantitative study. American Journal of Otolaryngology 9:58–67.
WALKER, E. P. 1968. Mammals of the world. Third edition. Johns Hopkins University Press, Baltimore, Maryland.
WALKER, R. S., W. G. FARMERIE, AND L. C. BRANCH. 2000. Characterization of microsatellite loci from the mountain vizcacha Lagidium viscacia and their use for the plains vizcacha Lagostomus maximus. Molecular Ecology 9:1672–1673.
WAYLEN, P. R., AND C. N. CAVIEDES. 1990. Annual and seasonal fluctuations of precipitation and stream flow in the Aconcagua River Basin, Chile. Journal of Hydrology 120:79–102.
WEBB, R. A. 1991. Chinchillas. Pp. 15–21 in Manual of exotic pets (P. H. Beynon and J. E. Cooper, eds.). British Small Animal Veterinary Association, Gloucestershire, United Kingdom.
WEIR, B. J. 1970. The management and breeding of some more hystricomorph rodents. Laboratory Animals 4:83–97.
WEIR, B. J. 1973. The induction of ovulation and oestrous in the chinchilla. Journal of Reproduction and Fertility 33:61–68.
WEIR, B. J. 1974. Reproductive characteristic of hystricomorph rodents. Symposia of the Zoological Society of London 34:265–301.
WEIR, B. J., AND I. W. ROWLANDS. 1974. Functional anatomy of the hystricomorph ovary. Symposia of the Zoological Society of London 34:302–332.
WEISSER, F., F. B. LACY, H. WEBER, AND R. L. JAMISON. 1970. Renal function in the chinchilla. American Journal of Physiology 219:1706–1713.
WILCOX, H. N. 1950. Histology of the skin and hair of the adult chinchilla. Anatomical Record 108:385–397.
WOODS, C. 1993. Suborder Hystricognathi. Pp. 771–806 in Mammal species of the world: a taxonomic and geographic reference (D. E. Wilson and D. M. Reeder, eds.). Second edition. Smithsonian Institution Press, Washington, D.C.
YARRELL, W. 1831. [Notes on a specimen of Chinchilla lanigera.] Proceedings of the Zoological Society of London 1831: 31–34.
ANGEL E. SPOTORNO AND J. PABLO VALLADARES, LABORATORIO DE GENÓMICA EVOLUTIVA, PROGRAMA DE GENÉTICA HUMANA, INSTITUTO DE CIENCIAS BIOMÉDICAS ICBM, FACULTAD DE MEDICINA, UNIVERSIDAD DE CHILE, CASILLA 70061, SANTIAGO 7, CHILE.
CARLOS A. ZULETA, DEPARTAMENTO DE BIOLOGÍA, FACULTAD DE CIENCIAS, UNIVERSIDAD DE LA SERENA, CASILLA 599, LA SERENA, CHILE.
AMY L. DEANE, CASILLA 302, ILLAPEL, CHILE.
JAIME E. JIMÉNEZ, LABORATORIO DE ECOLOGÍA, UNIVERSIDAD DE LOS LAGOS, CASILLA 933, OSORNO, CHILE.
Ассоциированные редакторы: GAIL MICHENER, PAMELA OWEN, and KRIS HELLGREN. Редактор VIRGINIA HAYSSEN.
Опубликовано 15 декабря 2004 года Американским обществом маммалиологов
Перевод с английского: Д.В. Михайлов.
Отдельная благодарность за помощь в редактировании Е.Л. Кириенко (биология) и Е.К. Климочкиной (ветеринария).
A. E. Spotorno, C. A. Zuleta, J. P. Valladares, A. L. Deane, and J. E. Jimenez. Chinchilla laniger // Mammalian Species No. 758, pp. 1–9


