Мартинез-Перейра М.А. и др. Экспериментальная модель тимпанических колик («острый живот») у шиншилл (Chinchilla lanigera)
Аннотация
Расстройства пищеварения, вызванные резкой сменой рациона питания или неподходящим рационом, лидируют среди распространенных нарушений в работе пищеварительной системы. Кишечная тимпания, возникающая в результате неправильного питания, провоцирует воспаление и характеризуется газообразованием, вздутием слепой и толстой кишки. Мы разработали метод экспериментальных тимпанических колик (ТК) у длиннохвостой шиншиллы для изучения воздействия кишечной тимпании на кишечные сплетения. Данный вид был выбран в силу склонности к тимпаническим коликам. ТК были спровоцированы несбалансированным питанием с повышенной долей люцерны и зерновых на протяжении двух недель. Физическое и клиническое обследования, включая болевой тест фон Фрея, подтвердили диагноз. Шиншиллы с острым животом получили лечение однопроцентным кетопрофеном и нормализацией рациона. Вскрытие и гистопатологический анализ показали вызванные тимпанией изменения в тканях, преимущественно слепой и толстой кишки. В результате проведенного лечения состояние стабилизировалось. Протокол ТК может быть использован как экспериментальный подход, способствующий изучению влияния острого кишечного воспаления и обструкции, вызванных несбалансированным рационом питания.
Ключевые слова: острый живот, воспаление кишечника, длиннохвостая шиншилла.
Для тимпанических колик (ТК) характерна невозможность выведения газов, образующихся в результате расщепления пищи ферментами кишечной микробиоты, что приводит к заметному растяжению стенок слепой и толстой кишки. Колики являются основной причиной заболевания и смертности лошадей. [1]. Желудочная или кишечная тимпания возникает как следствие несбалансированного рациона с избыточным содержанием клевера или люцерны, резкой смены рациона питания или воспаления желудочно-кишечного тракта. [2,3]. Изменение качества или количества пищи наряду со сменой графика кормления также увеличивают риск возникновения колик. [4]. В некоторых случаях, как например избыток зерновых в рационе, причина заболевания вполне очевидна, в то время как механизм возникновения и физиологические проблемы остаются невыясненными. [5]. Острое растяжение стенки кишки и последующее кишечное воспаление могут привести к резким изменениям структуры и физиологии энтеральной нервной системы (ЭНС). Принимая во внимание важность ЭНС в управлении секрецией и моторикой желудочно-кишечного тракта [6,7,8], знание об этиологии ТК может способствовать пониманию эффектов аналогичных расстройств пищеварения, связанных с ЭНС, таких как хронический запор и вздутие живота у жвачных млекопитающих и колик у лошадей.
Мы изучили различные аспекты анатомии, физиологии и репродукции [9,10,11,12,13] длиннохвостой шиншиллы. Шиншиллы являются травоядными животными с однокамерным желудком и ферментацией в нижней части кишечника. Некоторые авторы сравнивают их с лошадьми «в миниатюре» в отношении лечения желудочно-кишечных заболеваний [14,15]. Особенности анатомии желудочно-кишечного тракта шиншиллы, такие как сильно мешковидная форма слепой кишки и крупная толстая кишка, предрасполагают шиншиллу к возникновению ТК [9]. Поскольку шиншиллы более доступны для экспериментальных исследований, чем лошади и другие жвачные животные, мы использовали их для создания экспериментальной модели исследования этиопатогенеза брюшной тимпании.
Для эксперимента было отобрано пятнадцать особей вида Chinchilla lanigera с фермы Chillacenter (г. Виаман, шт. Риу-Гранди-ду-Сул, Бразилия) — 13 самок и 2 самца в возрасте от 18 до 32 месяцев и весом от 400 до 700 г. Животные содержались в индивидуальных клетках со свободным доступом к воде и корму промышленного производства Supra Chinchila компании Alisul Alimentos SA (Бразилия) со световым режимом 12 часов света / 12 часов темноты и контролируемой температурой воздуха в пределах 16–24°C. Все животные акклиматизировались в течение трех дней перед проведением экспериментальных процедур, начиная с нулевого дня (D0) вплоть до дня D3. Затем они были разделены на следующие группы: контрольная (5 особей), тимпаническая (5 особей) и восстановительная (5 особей). Все особи были умерщвлены путем введения летальной дозы кетамина и ксилазина (Pfizer, Бразилия). Данный экспериментальный подход был одобрен местным комитетом по этике в научных исследованиях (№ 2008148), а все проведенные с животными процедуры соответствовали закону Бразилии (Федеральный закон № 11.794 / 2008) о процедурах использования животных в научных целях. Схема эксперимента изображена на Рисунке 1.
Рисунок 1
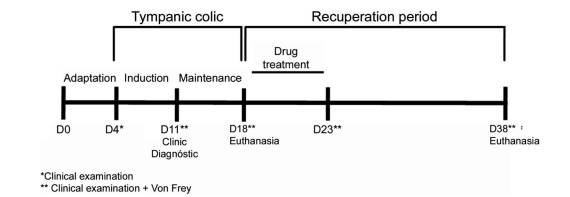
График процедур эксперимента. Дни D0–D4. Период акклиматизации и первое клиническое обследование. Дни D4–D18. Период тимпанической колики длился с D4 по D18 был разделен на два более коротких периода: индукция заболевания (дни D4–D11) и поддержание заболевания (дни D11–D18). Животных обследовали и провели анализ механической гиперчувствительности (тест фон Фрея, дни D11 и D18). Дни D18–D23. Период восстановления был разделен на два более коротких периода: медикаментозное лечение (D18–D23: одна инъекция 1% кетофена (2 мг/кг, внутримышечно) ежедневно) и последующее лечение (дни D23–D38). Животных обследовали и проводили анализ механической гиперчувствительности (тест фон Фрея) в дни D11 и D18.
Протокол индукции ТК шиншиллам был адаптирован на основании протоколов возникновения колик у лошадей [16] и путем анализа методов кормления, повышающих риск возникновения колик [4]. Вайс (Weiss et al. [16]) индуцировал ламинит после закупорки кишечника от его перегрузки зерном. Среди всех изученных схем кормления смена типа сухого фуража остается одним из наиболее значимых факторов развития колик [4]. Таким образом, протокол ТК содержал следующую диету, провоцирующую колики: 15% промышленного корма, 45% кукурузных зерен, 20% моркови, 5% семян подсолнечника и 15% люцерны в день. Кормление шиншилл производилось в фиксированном объеме (5% от массы тела (МТ) в исходном состоянии), составляющем в среднем 23,5 г/день, со свободным доступом животных к воде. Животных из тимпанической группы и восстановительной группы кормили в соответствии с диетой, вызывающей колики, ежедневно в течение пятнадцати дней (дни D3–D18), а животные контрольной группы ежедневно получали корм промышленного производства (5% от МТ в исходном состоянии) и люцерну в объеме 1,5% от МТ (в исходном состоянии) один раз в неделю. Данная смешанная диета основывается на предложенной Вольфом (Wolf et al. [17]). Люцерна описывается, как одна из наиболее распространенных причин чрезмерного газообразования у лошадей и крупного рогатого скота. Многие растительные соединения, такие как тритерпеновые сапонины, рассматриваются как факторы, способствующие возникновению колик у лошадей и вздутия живота у крупного рогатого скота [5,18]. Виэйра (Vieira et al. [19]) проанализировал 28 различных культурных сортов люцерны в Бразилии (Medicago sativa L.) и выявил в люцерне до 1,78% сапонина. Вне зависимости от уровня содержания сапонинов в люцерне применение данного бобового растения в диете шиншиллы рекомендуется лишь в небольшом количестве. После постановки диагноза ТК (день D18) животных из восстановительной группы кормили в соответствии с контрольной диетой и вводили лекарство 1% кетопрофен (2 мг/кг Ketofen® компании IM Merial, Бразилия) один раз в день в течение пяти дней (D18–D23), после того, как были завершены клинические обследования.
Клинический диагноз основывается на результатах физического обследования с использованием пальпации, аускультации и перкуссии живота. Животных обследовали в первый день (D0), после периода акклиматизации (день D4), во время периода кормления, вызывающего колики, для подтверждения начала заболевания (дни D11 и D18) и в течение периода восстановления животных восстановительной группы (дни D23 и D38). Анализ брюшной сенсибилизации проверяли с помощью датчика механического усилия (цифровой метод фон Фрея, Insight, Бразилия) в дни D11, D18, D23 и D38. Частоту прижатия лап в ответ на раздражители фон Фрея измеряли и использовали полученные данные в качестве показателя механической чувствительности брюшины (Рисунок 2). Данные по фон Фрею были выражены как среднее значение с учетом средней стандартной погрешности, а к средним значениям применяли дисперсионный анализ с повторными измерениями (ANOVA) для определения статистических различий в экспериментальных группах. Сравнения после исследования проводились с использованием теста Бонферрони. Различия между средними значениями рассматривали как значимые при условии, что P<0.05. Все животные тимпанической группы и три животных контрольной группы были умерщвлены в день D18, а животные восстановительной группы и два животных контрольной группы были умерщвлены после окончания противовоспалительного лечения в день D38.
Рисунок 2
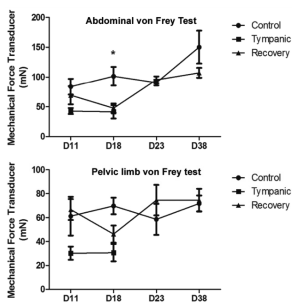
Брюшная чувствительность и частота прижатия лап в ответ на механическое воздействие (тест фон Фрея) у длиннохвостых шиншилл. Средняя сила вызова реакции у каждого животного рассчитывалась в миллиньютонах (мН) на основе трех последовательных измерений. Тест фон Фрея проводили в дни D11, D18, D23 и D38. Данные представлены как средние значения с учетом стандартной погрешности (n=5/группа). Применялся дисперсионный анализ с повторными измерениями (ANOVA) и тест Бонферрони. Звездочка указывает на то, что Р <0,05 при сравнении тимпанической группы и восстановительной группы с контрольной группой.
Никаких клинических изменений в дни D0–D4 у животных не наблюдалось. Через семь дней после начала изменения рациона, в день D11, у животных из тимпанической группы наблюдалось более высокое напряжение брюшной полости. Используя тест фон Фрея, были выявлены признаки брюшной чувствительности у животных тимпанической группы в день D11, указывающие на возникновение заболевания. Эти данные были подтверждены путем анализа прижатия лап в ответ на раздражители по методу фон Фрея (Рисунок 2). В день D18 эти симптомы сохранялись у животных тимпанической группы, и к ним добавились следующие: заметное усиление звуков при перкуссии брюшины, более раздутый живот, животные проявляли избегающее поведение во время пальпации, что указывает на возможную гипералгезическую реакцию. Тест фона Фрея, проведенный в день D18, показал увеличение брюшной чувствительности у животных из тимпанической группы (Figure 2). После проведения противовоспалительного лечения у животных из восстановительной группы на день D23 отсутствовали симптомы, наблюдаемые в день D18, и у них восстановился аппетит. В дни D11–D20 наблюдалось очевидное сокращение дефекации, а по окончании этого периода контрольные уровни дефекации восстановились в соответствии с пищевым поведением. В день D38 у животных восстановительной группы брюшная чувствительность проявлялась на уровне животных контрольной группы в соответствии с измерениями тестом фон Фрея.
Изменения на анатомическом уровне, спровоцированные тимпанической коликой, были подтверждены в результате аутопсии до извлечения толстой кишки для проведения других экспериментов (Рисунки 3A-C). Гистологические срезы сегментов слепой кишки и толстой кишки окрашивали гематоксилин-эозином и использовали для гистопатологического анализа (Рисунки 3E-G). Аутопсия животных тимпанической группы показала увеличение объема слепой кишки в сегментах между выростами кишки и восходящей ободочной кишки (Рисунки 3C-D). Ишемизированные очаги были обнаружены в еюноилеальном и илеоцекальных соединениях, а также в восходящей ободочной кишке (Рисунок 3D). Инфарктные зоны также наблюдались в мезентериальных сосудах по всему кишечнику Рисунок 3D). В поперечной и нисходящей ободочных кишках наблюдалось фекальное уплотнение, при этом прямая кишка была пустой. Уровень pH содержимого слепой кишки составил 7,0–8,0, что способствует поддержанию тимпанической колики пенистого и метаболического типа. У животных из тимпанической группы наблюдалось 50% увеличение объема слепой кишки (Рисунок 3B), однако у животных из восстановительной группы на этих участках объем соответствовал объему слепой кишки у животных контрольной группы (Рисунок 3A). У животных из восстановительной группы не было обнаружено инфарктных зон в мезентериальных кровеносных сосудах (Рисунок 3C).
Рисунок 3
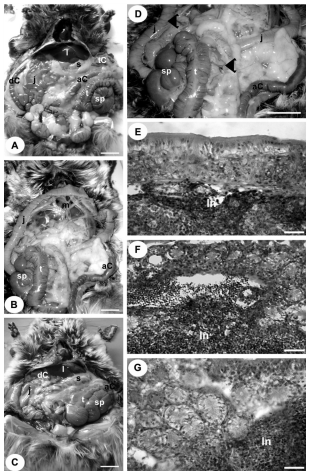
Вид брюшной полости снизу при исследовании путем аутопсии (AD) и гистопатологические изменения (E-G), вызванные протоколом экспериментальной тимпанической колики у длиннохвостой шиншиллы. A. Контрольное животное. B. У животного с тимпанической коликой наблюдается увеличение объема слепой кишки в сегментах между выростами кишки и восходящей ободочной кишки. Внутренние органы брюшной полости смещены вследствие увеличения объема слепой кишки. C. У животного из восстановительной группы после проведенного лечения препаратом объем слепой кишки восстановился до уровня, наблюдаемого у животных контрольной группы. D. Ишемизированные очаги и инфарктные зоны мезентериальных кровеносных сосудов (см. стрелки) наблюдались у животных из тимпанической группы в сравнении с животными контрольной (A) и восстановительной группы (C). E. У животного контрольной группы стенка мешковидной слепой кишки осталась без изменений. F. В эпителиальном слое стенки мешковидной слепой кишки у животного из темпанической группы наблюдаются множественные макрофаги, нейтрофилы и лимфоциты, а лимфатический узел простирается вплоть до собственной пластинки слизистой оболочки кишечника (правая сторона). G. В трубчатой слепой кишке наблюдается повышенное количество воспалительных клеток между железистой полостью и собственной пластинкой слизистой оболочки кишечника. Обратите внимание на нарушение работы мышечного слоя слизистой оболочки. Окрашивание гематоксилином и эозином (E–G). Отмечены следующие органы: печень (l), желудок (s), двенадцатиперстная кишка (d), тощая кишка (j), мешковидная часть (sp) и трубчатая часть (t) слепой кишки, восходящая ободочная кишка (aC), нисходящая ободочная кишка (dC), поперечная ободочная кишка (tC), мезентериальные сосуды (m) и лимфатический узел (ln). Линия: 2 см (A–D) и 100 мкм (E–G).
Отмеченные изменения слизистой оболочки кишечника в результате тимпанической колики указывают на подострый воспалительный процесс слепой и восходящей толстой кишки. Отличительным гистологическим признаком данного состояния является плотный лейкоцитарный инфильтрат, находящийся преимущественно в слизистой оболочке (Рисунок 3F). В железистой полости слепой кишки и восходящей ободочной кишке наблюдалось преобладание более плотного инфильтрата воспалительный клеток, включая макрофаги, нейтрофилы и лимфоциты (Рисунок 3G). Собственная пластинка восходящей ободочной кишки была более пористой, чем поперечная и нисходящая ободочная и прямая кишки. В толстой кишке животных из контрольной группы и восстановительной группы не наблюдалось никаких признаков воспаления (Рисунок 3E).
Клинический анализ, проведенный при аутопсии макроскопических аспектов кишечника и гистопатологических изменений в кишечнике животных из тимпанической группы, показал, что разработанный протокол подходит для индукции ТК длиннохвостым шиншиллам. По данным Кастро (Castro et al. [9]) объем слепой кишки шиншилл составляет в среднем 113,1 см3, в то время как у животных с ТК наблюдалось увеличение объема данного органа на 50%. Явные признаки воспаления слизистой оболочки, обнаруженные в день D18 тимпанического протокола, исчезли к дню D38 после проведения медикаментозного лечения и возобновления контрольной диеты. Тесты фон Фрея показали пониженную брюшную чувствительность в день D23, схожую с уровнем чувствительности у животных контрольной группы, наблюдаемую в день D38 (Рисунок 2). Это свидетельствует о том, что ранние обстоятельства острого живота (увеличение объема слепой кишки и воспаление слизистой оболочки) спровоцировали увеличение брюшной чувствительности в день D18. Несмотря на отсутствие контроля гибели клеток ишемизированных очагов у длиннохвостых шиншилл, клеточные изменения были указаны в описании воспалительного заболевания кишечника [20,21]. Сдавливание фекальных масс и задержка газов являются последствиями возможного снижения моторики кишечника у шиншилл с ТК. Снижение проталкивающей двигательной активности отмечалось у морских свинок при дистальном воспалении толстой кишки [22,23]. Эккерт (Eckert et al. [24]) описал нейтропению и лимфопению в образцах крови шиншиллы с ТК. В описанных им образцах плазмы также были обнаружены повышенные уровни щелочной фосфатазы (182 МЕ/л), креатинфосфокиназы (1096 МЕ/л) и мочевины (51,60 мг/дл). Данные, полученные из кишечного кровотока, указывают на острое воспаление и повреждение желудочно-кишечного тракта и могут отражать системное развитие ТК. Наличие инфильтрата воспалительных клеток, описанное в нескольких экспериментальных моделях колита у грызунов, вызывает изменения в электрофизиологических, нейрохимических и морфологических свойствах ЭНС и гладкой мускулатуры кишечника [25,26,27]. Однако специфические последствия острого живота для ЭНС остаются в значительной степени неизученными. Кроме того, воспалительные реакции на данный стимул у разных видов могут различаться [28]. Экспериментальные модели воспаления включали введение таких химических раздражителей, как уксусная кислота [29], горчичное масло или гаптены (например, тринитробензолсульфоновая кислота [30,31]), инфицирование паразитическими нематодами [32,33], добавление декстрана сульфата натрия [34] в питьевую воду или наружная обработка клеточным компонентом грамотрицательных бактерий, введение липополисахарида [35]. Протокол 18-дневного эксперимента с развитием тимпанической колики не привел к тяжелой форме воспаления, как некоторые из вышеупомянутых веществ, однако спровоцировал изменения, которые с большей вероятностью происходят из-за ошибок кормления, наблюдаемых в животноводстве. Такие ошибки в результате несбалансированной диеты могут привести к расстройству пищеварения у шиншилл и других мелких домашних млекопитающих. Степень повреждения внутренней и внешней иннервации кишечника, вызванного экспериментальной тимпанией, будет изучена в наших дальнейших исследованиях.
Благодарности
Это исследование было поддержано грантами Бразильского координационного совета по совершенствованию высшего образования (Capes) и Бразильского национального исследовательского совета (CNPq). Мы благодарны Cabanha Chillacenter (Viamão, RS, Brazil) за любезно предоставленных животных, использовавшихся в данном исследовании.
Использованные источники
1. Tinker MK, White NA, Lessard P, Thatcher CD, Pelzer KD, Davis B, Carmel DK. Prospective study of equine colic incidence and mortality. Equine Vet J 1997; 29(6): 448-453.
2. Hoefer HL. Chinchillas. Vet Clin North Am Small Anim Pract 1994; 24(1): 103-111.
3. Donnelly TM, Schaeffer DO. Disease problems of guinea pigs and chinchillas. In: Ferrets, Rabbits, and Rodents, Clinical Medicine and Surgery (Hillyer EV, Quesenberry KQ, Eds.), 1997; pp 270-281.
4. Gonçalves S, Julliand V, Leblond A. Risk factors associated with colic in horses. Vet Res 2002; 33(6): 641-652.
5. White NA II: Causes and risks for colic. AAEP Proceedings 2006; 52: 115-119.
6. Kunze WA, Furness JB, Bertrand PP, Bornstein JC. Intracellular recording from myenteric neurons of the guinea-pig ileum that respond to stretch. J Physiol 1998; 506: 827-842.
7. Saper CB. The central autonomic nervous system: conscious visceral perception and autonomic pattern generation. Annu Rev Neurosci 2002; 25: 433-469.
8. Jänig W. The integrative action of the autonomic nervous system: Neurobiology of homeostasis. Cambridge University Press, Cambridge, 2006; pp 168-208.
9. Castro TF, Dummer RJ, Rickes EM, Pereira MAM. Morphological, morphometric and topographical description of the digestive tract in Chinchilla lanigera. Braz J Vet Res Anim Sci 2010; 47: 86-94.
10. Martinez-Pereira MA, Rickes EM. The spinal nerves that constitute the lumbosacral plexus and their distribution in the chinchilla. J S Afr Vet Assoc 2011; 82(3): 150-154.
11. Brown TA, Harrison RV. Responses of neurons in chinchilla auditory cortex to frequency modulated tones. J Neurophysiol 2009; 101(4): 2017-2029.
12. Jakubów K, Gromadzka-Ostrowska J, Zalewska B. Seasonal changes in the haematological indices in peripheral blood of chinchilla (Chinchilla laniger L.). Comp Biochem Physiol A Comp Physiol 1984; 78(4): 845-885.
13. Busso JM, Ponzio MF, Fiol de Cuneo M, Ruiz RD. Reproduction in chinchilla (Chinchilla lanigera): current status of environmental control of gonadal activity and advances in reproductive techniques. Theriogenology 2012; 78(1): 1-11.
14. O’Malley B. Introduction to small mammals. In: Clinical anatomy and physiology of exotic species, Saunders, New York, 2005, pp 165-171.
15. Klaphake E. Common rodent procedures. Vet Clin North Am Exot Anim Pract 2006; 9(2): 389-413.
16. Weiss DJ, Evanson OA, McClenahan D, Fagliari JJ, Dunnwiddie CT, Wells RE. Effect of a competitive inhibitor of platelet aggregation on experimentally induced laminitis in ponies. Am J Vet Res 1998; 59(7): 814-817.
17. Wolf P, Schröder A, Wenger A, Kamphues J. The nutrition of the chinchilla as a companion animal--basic data, influences and dependences. J Anim Physiol Anim Nutr (Berl) 2003; 87(3-4): 129-133.
18. Clarke RT, Reid CS. Foamy bloat of cattle. A review. J Dairy Sci 1974; 57(7): 753-785.
19. Vieira MEQ, Costa C, Silveira AC, Arrigoni MB. Porcentagens de saponinas e taninos em vinte e oito cultivares de alfafa (Medicago sativa L.) em duas épocas de corte -Botucatu- SP. Rev Bras Zootec 2001; 30: 1432-1438.
20. Johnson-Delaney, CA. 2008. Exotic Companion Medicine Handbook for Veterinarians. Zoological Education Network. Florida. pp 98.
21. Sanovic S, Lamb DP, Blennerhassett MG. Damage to the enteric nervous system in experimental colitis. Am J Pathol 1999; 155(4): 1051-1057.
22. Sharkey KA, Kroese AB. Consequences of intestinal inflammation on the enteric nervous system: neuronal activation induced by inflammatory mediators. Anat Rec 2001; 262(1): 79-90.
23. Linden DR, Sharkey KA, Ho W, Mawe GM. Cyclooxygenase-2 contributes to dysmotility and enhanced excitability of myenteric AH neurones in the inflamed guinea pig distal colon. J Physiol 2004; 557: 191-205.
24. Eckert BS, Funkler GR, Rodrigues SV. Case report: Acute abdomen in chinchilla. UFRGS 2011.
25. Collins SM. The immunomodulation of enteric neuromuscular function: implications for motility and inflammatory disorders. Gastroenterology 1996; 111(6): 1683-1699.
26. Lomax AE, Fernández E, Sharkey KA. Plasticity of the enteric nervous system during intestinal inflammation. Neurogastroenterol Motil 2005; 17(1): 4-15.
27. Vasina V, Barbara G, Talamonti L, Stanghellini V, Corinaldesi R, Tonini M, De Ponti F, De Giorgio R. Enteric neuroplasticity evoked by inflammation. Auton Neurosci 2006; 126-127: 264-272.
28. Mawe GM, Strong DS, Sharkey KA. Plasticity of enteric nerve functions in the inflamed and postinflamed gut. Neurogastroenterol Motil 2009; 21(5): 481-491.
29. Valentine JF, Tannahill CL, Stevenot SA, Sallustio JE, Nick HS, Eaker EY. Colitis and interleukin 1beta up-regulate inducible nitric oxide synthase and superoxide dismutase in rat myenteric neurons. Gastroenterology 1996; 111(1): 56-64.
30. Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology 1989; 96(3): 795-803.
31. Reinshagen M, Rohm H, Steinkamp M, Lieb K, Geerling I, Von Herbay A, Flämig G, Eysselein VE, Adler G. Protective role of neurotrophins in experimental inflammation of the rat gut. Gastroenterology 2000; 119(2): 368-376.
32. Barbara G, Vallance BA, Collins SM. Persistent intestinal neuromuscular dysfunction after acute nematode infection in mice. Gastroenterology 1997; 113(4): 1224-1232.
33. Chen Z, Suntres Z, Palmer J, Guzman J, Javed A, Xue J, Yu JG, Cooke H, Awad H, Hassanain HH, Cardounel AJ, Christofi FL. Cyclic AMP signaling contributes to neural plasticity and hyperexcitability in AH sensory neurons following intestinal Trichinella spiralis-induced inflammation. Int J Parasitol 2007; 37(7): 743-761.
34. Kimball ES, Schneider CR, Wallace NH, Hornby PJ. Agonists of cannabinoid receptor 1 and 2 inhibit experimental colitis induced by oil of mustard and by dextran sulfate sodium. Am J Physiol Gastrointest Liver Physiol 2006; 291(2): G364-G371.
35. Yuan PQ, Wu SV, Wang L, Taché Y. Corticotropin releasing factor in the rat colon: expression, localization and upregulation by endotoxin. Peptides 2010; 31(2): 322-331.
Авторы:
Malcon Andrei Martinez-Pereira 1,2, Raphaela da Cunha Franceschi 2,3, Bárbara Paranhos Coelho2,Gustavo da Rosa Fünkler2, Denise Maria Zancan 2,3*
1 Centro Ciências da Saúde,Universidade de Cruz Alta, Cruz Alta, Brazil
2 Laboratório de Neurobiologia Comparada, Departamento de Fisiologia, Instituto de Ciências Básicas da Saúde, Universidade Federal do Rio Grande do Sul, Porto Alegre, Brazil
3 Programa de Pós-Graduação em Neurociências, Instituto de Ciências Básicas da Saúde (ICBS), Universidade Federal do Rio Grande do Sul, Porto Alegre, Brazil
Поступило 26 мая 2014 г .; Исправленная версия получена 4 сентября 2014 г .; Принята в печать 11 сентября 2014 г.
Перевод: Е. Поваляева
Перевод выполнен в соответствии с лицензией Creative Commons Attribution License 4.0 . При публикации данного перевода ссылка на авторов оригинальной работы, как и на автора перевода обязательна.
Malcon Andrei Martinez-Pereira, Raphaela da Cunha Franceschi, Bárbara Paranhos Coelho,Gustavo da Rosa Fünkler, Denise Maria Zancan, Experimental model of tympanic colic (acute abdomen) in chinchillas (Chinchilla lanigera) (Экспериментальная модель тимпанических колик («острый живот») у шиншилл (Chinchilla lanigera)) // Lab Anim Res, September, 2014, Vol. 30, No. 3